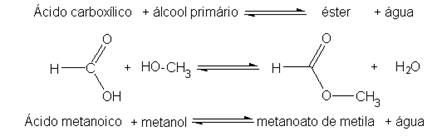
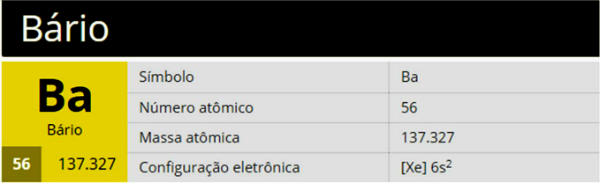
Le baryum est un élément chimique de symbole Ba, de numéro atomique 56 et de masse atomique 137 327, appartenant au groupe 2 (famille 2A) du tableau périodique, étant un métal alcalino-terreux.
Son nom vient du grec bary et cela signifie lourd.
Caractéristiques
A température ambiante, on le trouve à l'état solide, avec une consistance molle et une couleur argentée. Cependant, dans la nature, il ne se trouve pas sous sa forme pure, car il s'oxyde facilement au contact de l'air.
Le baryum se trouve dans les minerais de barytine (BaSO4) et de la withérite (BaCO3). Les principales zones d'extraction de ces minerais se trouvent au Royaume-Uni, en Italie, en République tchèque, aux États-Unis et en Allemagne.
Le baryum a des points de fusion élevés (1000 K - 727 °C) et d'ébullition (2170 K - 1897 °C). C'est toujours un bon conducteur d'électricité.
Il est très réactif au contact de l'eau et de l'alcool. Sa réaction avec l'eau produit de l'hydroxyde et libère hydrogène.
Les composés solubles du baryum sont toxiques pour l'organisme. Bien qu'il se trouve dans l'eau et la nourriture, la quantité de baryum présente n'est pas suffisante pour causer des problèmes de santé.
En raison de son haut pouvoir oxydant, le baryum doit être conservé dans de l'huile minérale.
En savoir plus, lire aussi :
- Éléments chimiques
- Tableau périodique
applications
Parmi les principales applications du baryum figurent :
- Sous sa forme pure, il est utilisé pour l'élimination de l'oxygène des valves électroniques ;
- Mort-aux-rats, sous forme de carbonate de baryum;
- Utilisé comme pigment blanc dans les peintures;
- Production de verre;
- Le sulfate de baryum est utilisé comme fluide pour le forage de puits de pétrole et de gaz;
- Le chlorate et le nitrate de baryum sont utilisés dans la production de flammes vertes dans les fusées pyrotechniques ;
- Le sulfure de baryum améliore le contraste pour les examens radiographiques du système digestif et est administré par voie orale aux patients. L'ingestion ne cause pas de problèmes de santé, car la substance est insoluble, ne s'accumule pas et est rapidement éliminée de l'organisme ;
Alors que le sulfure de baryum est inoffensif, le carbonate de baryum est extrêmement toxique et peut être mortel. La personne en état d'intoxication a des difficultés respiratoires, des vomissements, des tremblements, une tachycardie, une augmentation de la pression artérielle et de la salivation.
Vous pouvez également être intéressé par :
- Liens métalliques
- Cuivre
- Lithium