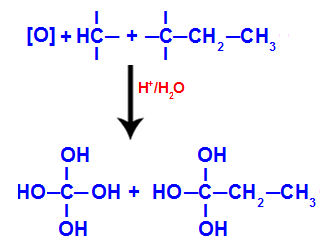
La différence de potentiel (ddp) d'un la batterie est le courant électrique produit à partir de deux électrodes par les phénomènes de oxydation et réduction. On peut aussi appeler force électromotrice ddp (dont l'abréviation est emf) ou variation de potentiel (dont l'abréviation est ΔE).
La tension électrique générée lorsque les électrons se déplacent de l'électrode qui subit l'oxydation vers l'électrode qui subit la réduction est la ddp, qui est toujours indiqué par l'unité Volts (symbole V).
La tension ddp produite dans une cellule dépend du potentiel des électrodes. Chaque électrode a une capacité à s'oxyder ou à se réduire, donc si elle s'oxyde, c'est parce que son potentiel d'oxydation a dépassé celui de l'autre électrode ou vice versa.
? calcul ddp
Pour calculer ddp d'une batterie, il faut connaître les potentiels de réduction ou d'oxydation de chacune des électrodes :
E = Eréduction importante - ETréduction mineure
ou alors
E = Eune plus grande oxydation - EToxydation mineure
Le potentiel de réduction d'une électrode a la même valeur que son potentiel d'oxydation, mais de signe opposé.
? Exemples de calcul ddp
(ESCS-DF) Les piles et les batteries sont des dispositifs dans lesquels un courant électrique est produit par une réaction d'oxydoréduction. Connaître les potentiels standards de réduction des électrodes :
Cul2+ + 2 et– Cu E° = + 0,34 V
Ag+ + et– AgE° = + 0,80 V
La différence de potentiel standard (ΔE°) du Cu | Cul2+ (1M) || Ag+ (1M) | Ag est égal à :
a) 0,12 V b) 0,46 V c) 1,12 V d) 1,14 V e) 1,26 V
Résolution:
ETréduction importante = + 0.80V
ETréduction mineure = + 0.34V
E = Eréduction importante - ETréduction mineure
E = 0,80 - 0,34
E = 0,46V.
(UESPI) Une contribution importante d'Eletroquímica à notre quotidien sont les batteries portables utilisées dans les équipements électroniques. Ces batteries sont des cellules électrochimiques dans lesquelles le courant - le flux d'électrons à travers le circuit - est produit par une réaction chimique spontanée ou pour forcer le traitement d'une réaction qui ne spontané. En ce sens, une cellule galvanique utilise des réactions d'oxydoréduction pour convertir l'énergie chimique en énergie électrique. Déterminer la tension produite par une cellule galvanique dans laquelle la réaction a lieu
Ag+(ici) + Cr2+(ici) → Ag(s) + Cr3+(ici),
et où les concentrations ioniques sont égales à 1 mol. L–1. Données de potentiel d'oxydation standard à 25 °C :
Cr2+(ici) → et– + Cr3+(ici) E = -0,41V
Ag(s) → et– + Ag+(ici) E = - 0.80V
a) -0,39 V b) +0,39 V c) -1,21 V d) +1,21 V e) +1,61 V
Résolution:
ETune plus grande oxydation = + 0.80V
EToxydation mineure = -0,80V
E = Eune plus grande oxydation - EToxydation mineure
E = -0,41 - (-0,80)
E = -0,41 + 0,80
E = 0,39V.
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ddp-de-uma-pilha.htm