LES hybridation de carbone de type sp cela ne se produit que lorsqu'il fait deux liaisons pi (π) et deux liaisons sigma (σ). Dans ce cas, alors, il y a deux possibilités: le carbone peut faire deux doubles liaisons ou une simple et une triple liaison, comme indiqué ci-dessous :
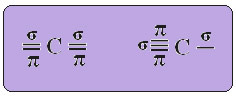
Le texte "hybridation de type sp3» montre en détail comment se déroule l'hybridation du carbone. Rappel: l'hybridation est le « mélange » d'orbitales atomiques pures, qui sont à l'origine d'orbitales atomiques hybrides équivalentes les unes aux autres, mais différentes des orbitales pures d'origine. Donc, cela se produit dans les orbitales de carbone qui étaient à l'origine représentées comme ceci :
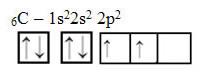
Cependant, avec la réception d'énergie, un électron (représenté par une flèche) de l'orbitale 2s est promu à l'orbitale 2p :
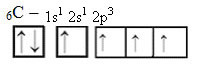
De cette façon, le carbone a quatre orbitales non appariées, pouvant faire quatre liaisons covalentes, pas seulement deux.
Dans le cas de l'hybridation de type sp, on sait que deux liaisons seront pi; ceux-ci se produisent dans les orbitales "p" pures, tandis que les deux autres orbitales, qui sont des hybrides sp, feront les liaisons sigma restantes.
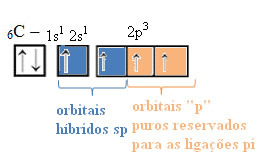
La représentation spatiale de cette hybridation entre une orbitale s et une p, donnant lieu à une orbitale sp hybride, peut être représentée comme suit :
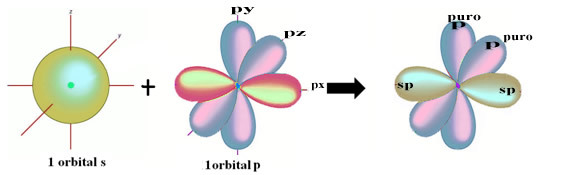
Dans la figure ci-dessus, il est très clair qu'il existe deux orbitales pures qui créeront les liaisons pi.
Pour que vous compreniez comment cela se passe, prenons comme exemple une molécule de gaz cyanure (HCN), utilisée aux États-Unis dans les chambres à gaz pour les condamnés à mort. Sa formule développée est donnée par :
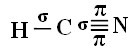
Quant au carbone, ses orbitales atomiques ont déjà été montrées, regardez maintenant les orbitales d'hydrogène et d'azote :
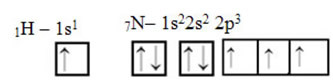
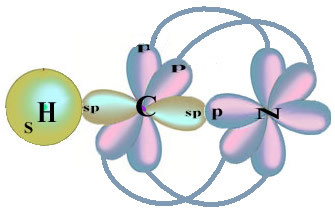
Notez que l'orbitale d'hydrogène non appariée qui effectuera la liaison sigma est le « s », qui est spatialement représenté par un cercle; et les orbitales d'azote sont de type « p », représentées par trois doubles ovoïdes (chacun dans un champ spatial: x, y, z). Ainsi, la structure de la molécule HCN est représentée comme suit :
Quant au type de liaisons existant dans cette structure formaldéhyde, on a :
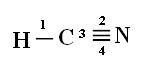
Connexions: 1 = σs-sp
2 = σp-sp
3 = 4 = πp-p
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm