Dans de nombreux médicaments et produits alimentaires liquides et solides, tels que le vinaigre et les biscuits, par exemple, le teneur en pourcentage massique du soluté (m1) par rapport à la masse de la solution entière (m = m1 + m2). Cette grandeur est appelée Titre (T) ou pourcentage massique d'une solution.
Sa définition peut être exprimée comme suit :

Ainsi, son calcul se fait grâce à l'équation mathématique ci-dessous :
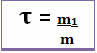
ou alors

Étant donné que le dénominateur et le numérateur traitent de la même unité (l'unité de masse est le gramme - g), le titre n'a pas d'unité et est inférieur à 1.
Ainsi, si on dit que le titre d'une solution donnée est 0,4, cela signifie que pour chaque unité de masse de la solution, 0,4 correspond à la masse du soluté. Cependant, le titre est souvent exprimé en pourcentage. Pour cela, il suffit de multiplier la valeur trouvée par 100 %. Dans ce cas on l'appelle Pourcentage de masse (T%) *
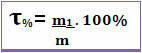
Notez la figure ci-dessous, dans laquelle est donné le pourcentage massique de chlorure de sodium dans une solution saline :

Le sérum physiologique, utilisé dans le traitement de la déshydratation, contient un pourcentage massique de chlorure de sodium de 0,9%
Dans ce cas, cela signifie que pour 100 g ou 100 unités de cette solution, il y a 0,9 g ou 0,9 % de soluté, c'est-à-dire de chlorure de sodium (NaCl – sel de table).
Un autre exemple est le vinaigre: sur son étiquette, il est indiqué que 5% de la masse d'acide acétique a été utilisé dans sa préparation, c'est-à-dire qu'il y a 5 g de cet acide pour 100 g de solution.

Le titre peut également être donné en pourcentage de volume. Dans ce cas, la seule différence est qu'au lieu de rapporter la masse du soluté à la masse de la solution; le volume du soluté est lié au volume de la solution, selon la formule suivante :
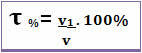
Par exemple, dans le cas de l'alcool ordinaire, qui a un pourcentage en volume de 96 %, dans 100 ml de solution, 96 ml sont de l'alcool.

* Le terme « Titre » est plus utilisé parmi les scientifiques, tandis que les techniciens et plusieurs auteurs de livres utilisent plus souvent l'expression « Pourcentage en masse ».
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/titulo-ou-porcentagem-massa.htm

