UN électrosphère est la région de l'atome dans laquelle les électrons Ils sont localisés. L'électrosphère, plus précisément, est composée d'orbitales atomiques, déterminées en résolvant l'équation de Schrödinger. Déterminée pour la première fois par le modèle de Rutherford, l'électrosphère a connu des progrès significatifs au cours de la validité du modèle atomique de Bohr.
L'électrosphère peut être divisée en couches (ou niveaux d'énergie), car les électrons ont une énergie définie (non continue). Pour les atomes comportant deux électrons ou plus, les coquilles se divisent en sous-couches (ou sous-couches). L'électrosphère est extrêmement importante pour comprendre les propriétés de l'atome et comprendre la formation des liaisons chimiques.
A lire aussi: Comment l’atome est-il divisé ?
Résumé sur l'électrosphère
L'électrosphère est la région de l'atome dans laquelle se trouvent les électrons.
Il est composé d'orbitales atomiques, de fonctions d'onde qui sont des solutions aux équations de Schrödinger.
Son concept a commencé avec le modèle d'Ernest Rutherford.
Les électrons sont retenus dans l’électrosphère en raison de leur attraction vers le noyau atomique.
Les principales avancées dans la compréhension de l'électrosphère ont eu lieu lors de la conception du modèle de Niels Bohr.
Il est composé de couches (ou niveaux d'énergie), qui sont des régions d'énergie définie.
Pour les atomes comportant plus d’un électron, les coquilles se divisent en sous-couches (ou sous-couches).
L'électrosphère est importante pour comprendre plusieurs propriétés, telles que la similarité atomique, la stabilité, rayon atomique, énergie d'ionisation, affinité électronique, en plus de comprendre la formation des liaisons produits chimiques.
Leçon vidéo sur l'électrosphère
Qu'est-ce que l'électrosphère ?
L'électrosphère est définie comme la région de la structure atomique dans laquelle se trouvent les électrons. Dans des interprétations plus approfondies, nous disons qu'il est composé d'orbitales atomiques, de fonctions d'onde qui sont des solutions à l'équation de Schrödinger. L'expression mathématique d'une orbitale atomique, lorsqu'elle est mise au carré, présente la densité de probabilité de l'emplacement de l'électron en un point donné.
Ô Le concept d'électrosphère a commencé à émerger avec Le modèle atomique d'Ernest Rutherford, qui présente des électrons en orbite autour d’un noyau dense et positif. Plus tard, Niels Bohr a apporté des interprétations plus significatives de l'électrosphère en mélangeant des concepts issus de la mécanique quantique.
Couches de l'électrosphère
Les électrons sont retenus dans l’électrosphère en raison de leur attraction vers le noyau atomique. Or, on sait que ces les électrons sont dans des coquilles dont les énergies sont bien définies. Ces couches peuvent également être appelées niveaux d’énergie.
Cette conclusion est venue après des expériences de spectroscopie. Par exemple, lorsqu'un courant électrique est appliqué au gaz H2 À basse pression, la lumière est émise par H2. Dans cette condition, des ions H se forment+ et des électrons, qui reviendront aux ions H+ et formera des espèces excitées (énergisées) de H+. Pour évacuer l'excès d'énergie, les ions H+ libère de l'énergie sous forme de rayonnement électromagnétique (lumière) et se recombine en gaz H2 encore.
Vous vous souvenez peut-être que lorsque la lumière blanche traverse un prisme, elle se décompose en un spectre continu (semblable à un arc-en-ciel); cependant, la même chose ne se produit pas avec la lumière provenant de H2: lorsqu'un tel rayonnement traverse le prisme, seules des raies brillantes d'une longueur d'onde définie sont observées dans le spectre d'émission H2, connues sous le nom de raies spectrales.
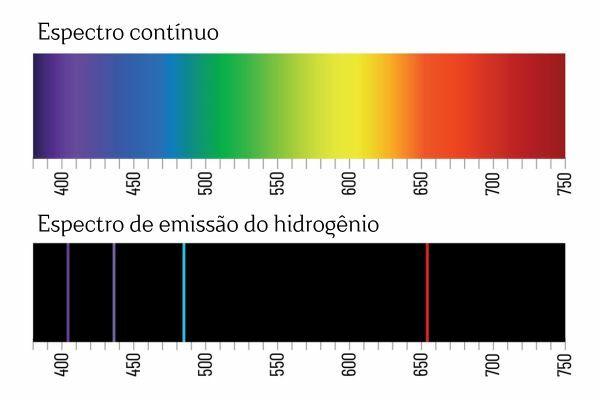
L'interprétation des spectres d'émission des éléments (avec des raies spectrales bien définies) est la suivante un électron, dans un atome, ne peut présenter aucune énergie, mais plutôt en quantités bien définies (appelés paquets d'énergie). Si les électrons n’avaient pas de telles restrictions énergétiques, le spectre d’émission des éléments serait continu, tout comme celui de la lumière blanche traversant un prisme.
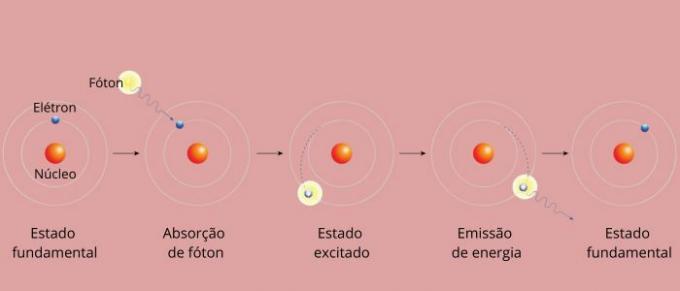
Chaque raie spectrale d’un élément est devenue connue sous le nom de niveau d’énergie. (ou couche, comme on a plus l'habitude de dire). Ces lignes apparaissent lorsqu'un électron passe d'un niveau d'énergie autorisé à un autre, dans un processus de changement d'énergie appelé transition électronique.
Lors de la transition électronique, l’électron passe d’un niveau d’énergie inférieur à un niveau d’énergie supérieur. En revenant à son niveau initial, il émet un excès d'énergie par rayonnement électromagnétique (lumière), donnant origine à la raie spectrale dont la valeur d'énergie émise est proportionnelle à une valeur définie par l'équation de Rydberg.
Johannes Rydberg était un spectroscopiste suédois qui a créé une équation pour définir la tendance des raies spectrales basée sur les travaux du professeur suisse Johann Balmer. L'énergie spécifique de chaque couche est définie en résolvant l'équation de Schrödinger appropriée.
Chaque couche électronique possède un certain nombre d'électrons autorisés. Actuellement, sept couches électroniques sont définies, identifiées par les lettres K à Q, par ordre alphabétique, ou par la lettre n, où n ≥ 1. Ainsi, la couche K est la couche où n = 1, et ainsi de suite. Le nombre d'électrons autorisés par couche est indiqué dans le tableau suivant.
Niveau d'énergie |
Couche |
Nombre maximum d'électrons |
1 |
K |
2 |
2 |
L |
8 |
3 |
M |
18 |
4 |
N |
32 |
5 |
Ô |
32 |
6 |
P. |
18 |
7 |
Q |
8 |
Pour les atomes hydrogénoïdes (avec seulement 1 électron, comme H, He+, Li2+), toutes les orbitales atomiques ont la même énergie (on les appelle orbitales dégénérées); cependant, dans les atomes comportant deux électrons ou plus, un effet très important se produit, la répulsion électron-électron. La conséquence de ce fait est que les orbitales de chaque couche commencent à avoir des énergies différentes et, par conséquent, les couches commencent à être décrites comme des sous-couches (ou sous-niveaux).
Pour les atomes actuels, chaque couche peut être décomposée en quatre sous-niveaux maximum, représenté par les lettres « s » (de l'anglais, pointu), « p » (de l'anglais, principal), « d » (de l'anglais, diffusif) et « f » (de l'anglais, fondamental).
Chaque sous-niveau supporte un nombre maximum d'électrons, défini par des calculs et des expériences. Le sous-niveau « s » prend en charge jusqu'à 2 électrons; le sous-niveau « p », jusqu'à 6 électrons; le sous-niveau « d », jusqu'à 10 électrons; et le sous-niveau « f », jusqu'à 14 électrons. La couche K est la seule qui n’autorise qu’une seule orbitale et ne comporte donc qu’un seul sous-niveau.
Niveau d'énergie |
Couche |
Sous-niveaux |
1 |
K |
1s |
2 |
L |
2s, 2p |
3 |
M |
3s, 3p, 3d |
4 |
N |
4s, 4p, 4d, 4f |
5 |
Ô |
5s, 5p, 5j, 5f |
6 |
P. |
6s, 6p, 6j |
7 |
Q |
7s, 19h |
Fonction de l'électrosphère
L'électrosphère de chaque atome peut être utilisé pour expliquer diverses propriétés et comportements de l’atome.
Des propriétés telles que le rayon atomique, le rayon ionique, l'énergie d'ionisation et l'affinité électronique ont des valeurs qui sont une conséquence directe de la configuration électronique de l'électrosphère, plus précisément de la appelé coque de valence, qui est en fait la coque électronique occupée la plus externe d’un atome ou d’un ion.
UN la similarité entre les atomes du même groupe dans le tableau périodique est également une conséquence de la configuration électronique de la coque de valence. Dans les processus chimiques, nous choisissons autant que possible les atomes du même groupe dans le tableau périodique. substituants, et cela n'est que plausible, car ces atomes ont la même configuration électronique dans la couche de valence.
Au liaisons chimiques, qui se produisent entre les atomes pour former des composés ioniques et covalents (molécules), se produisent également par le biais d'interactions entre les électrosphères des atomes.
Lire aussi: Le modèle atomique de Schrödinger — manière de décrire l'atome en utilisant la mécanique quantique
Relation entre l'électrosphère et la structure atomique
Comme indiqué, l’électrosphère englobe la région de l’atome dans laquelle se trouvent les électrons. Les électrons, plus précisément, sont situés dans des orbitales atomiques dont l’énergie est définie par des calculs quantiques.
L'électrosphère est la plus grande région de la structure atomique, puisque le noyau d’un atome est très petit. En considérant l’atome comme un stade de football, le noyau correspondrait à un ballon au centre du terrain, tandis que le reste du stade serait l’électrosphère.
Néanmoins, en termes de masse, l'électrosphère contribue peu. Comme la masse des électrons est environ 1 836 fois inférieure à celle des protons et des neutrons, on peut dire que la quasi-totalité de la masse de l’atome est concentrée dans le noyau.
Exercices résolus sur l'électrosphère
question 1
(Facisb 2023) Dans le modèle de Bohr pour l'atome d'hydrogène, l'électron ne peut occuper que certaines orbites. Certaines de ces orbites sont représentées sur la figure, où n fait référence aux niveaux d'énergie que possède l'électron sur chaque orbite.
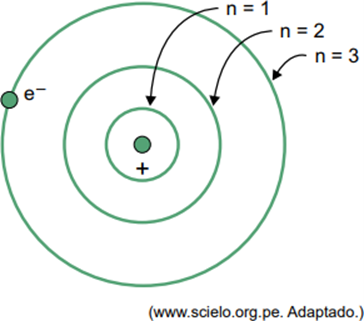
Considérons que, dans un atome d’hydrogène, l’électron est sur l’orbite où n = 5.
Selon le modèle de Bohr, cet électron n'émettra de l'énergie sous forme de rayonnement électromagnétique que lorsque
(A) faire une transition vers l’orbite sur laquelle n est égal à 6.
(B) restent sur l’orbite où n = 5.
(C) transition vers toute orbite dans laquelle n est supérieur à 5.
(D) transition vers toute orbite dans laquelle n est inférieur à 5.
(E) est éjecté de l’atome, l’ionisant.
Réponse: Lettre D
Lorsqu’un électron se trouve dans une coque externe, lors de son retour dans une coque interne avec une énergie inférieure, il libère un excès d’énergie sous forme de rayonnement électromagnétique (lumière). Par conséquent, l’apparition de la lumière ne se produira que lorsque l’électron présent dans n = 5 effectuera une transition vers une couche interne.
question 2
(Uerj 2019) Récemment, des scientifiques ont réussi à produire de l'hydrogène métallique en comprimant de l'hydrogène moléculaire sous haute pression. Les propriétés métalliques de cet élément sont les mêmes que celles des autres éléments du groupe 1 du tableau de classification périodique.
Cette similarité est liée au sous-niveau le plus énergétique de ces éléments, qui correspond à :
(A) ns1
(B) n.p.2
(C) na3
(D) nf4
Réponse: Lettre A
L'atome d'hydrogène ne possède qu'un seul électron, situé au premier niveau, sous-niveau « s » (1s1). Une des raisons pour lesquelles on le trouve dans le groupe 1 du tableau périodique est que tous les autres éléments chimiques de ce groupe ont des atomes dont la couche de valence est du même type (ns1). Par conséquent, grâce à une couche de valence similaire, l’hydrogène a pu être produit sous cette forme métallique.
Sources:
DO CANTO, E. L.; LEITE, L. L. W.; CANTO, L. W. Chimie – au quotidien. 1. éd. São Paulo: Moderna, 2021.
ATKINS, P.; JONES, L.; LAVERMAN, L. Principes de chimie: questionner la vie et l'environnement. 7. éd. Porto Alegre: Bookman, 2018.
ATKINS, P.; DE PAULA, J.; KEELER, J. Chimie physique d'Atkins. 11 éd. Oxford: Presse universitaire d'Oxford, 2018.
