LES solubilité, ou coefficient de solubilité, c'est une propriété physique de la matière qui est toujours pratiquement déterminée en laboratoire. Elle est liée à la capacité qu'un matériau, appelé soluté, présente pour être dissous par un autre, le solvant.
Quant à la solubilité, les solutés peuvent être classés comme suit :
Soluble : ceux qui se dissolvent dans le solvant. Le chlorure de sodium (soluté), par exemple, est soluble dans l'eau (solvant) ;
Légèrement soluble: ceux qui ont du mal à se dissoudre dans le solvant. C'est le cas de l'hydroxyde de calcium [Ca(OH)2] (soluté) dans l'eau;
Insolubles : ceux-ci ne se dissolvent pas dans le solvant. Le sable (soluté), par exemple, est insoluble dans l'eau.
LES solubilité est très associé à la préparation de solutions (mélanges homogènes), car pour obtenir une solution, il est essentiel que le soluté utilisé soit soluble dans le solvant.
Facteurs influençant la solubilité
Même lorsque le soluté est soluble dans le solvant, certains facteurs peuvent influencer la capacité du soluté à se dissoudre. Sont-ils:
a) Relation entre la quantité de soluté et de solvant
Le solvant a toujours une limite de soluté qu'il peut dissoudre. Si on augmente la quantité de solvant tout en maintenant la quantité de soluté, le solvant a tendance à dissoudre tout le soluté utilisé.
B) Température
La température est le seul facteur physique capable de modifier la solubilité d'un solvant par rapport à un soluté donné. Cette modification dépend de la nature du soluté, comme nous le verrons ci-dessous :
soluté endothermique: est celui que l'on parvient à dissoudre une masse plus importante, tant que le solvant est à une température supérieure à la température ambiante. Plus le solvant est chaud, plus le soluté se dissoudra.
Exemple: Il est possible de dissoudre une plus grande quantité de café moulu lorsque l'eau est chaude.
Soluté exothermique : est celui que l'on parvient à dissoudre une masse plus importante, tant que le solvant est à une température inférieure à la température ambiante. Plus le solvant est froid, plus le soluté se dissoudra.
Exemple: Il est possible de dissoudre une plus grande quantité de dioxyde de carbone lorsque la soude est froide.
Façons de déterminer la solubilité
La solubilité étant une propriété déterminée de manière expérimentale, les matériaux, en général, ont déjà vu leurs solubilités évaluées dans les solvants les plus différents. Ainsi, nous pouvons accéder à la solubilité d'un soluté dans un certain solvant comme suit :
a) Analyse d'un tableau
Souvent, l'étudiant peut découvrir la solubilité à partir de l'interprétation d'un tableau. Voir l'exemple suivant :
Exemple: (UEPG - adapté) Le tableau ci-dessous montre la solubilité du sel de Li2CO3 dans 100 grammes d'eau.

Le tableau présente les valeurs de masse en grammes de Li2CO3 qui peut être dissous dans 100 grammes d'eau, de 0 OC à 50 OÇ. Nous pouvons voir que plus l'eau est chaude, moins Li2CO3 se dissout. Par conséquent, Li2CO3 c'est un soluté exothermique (il se dissoudra davantage si l'eau est froide).
b) Analyse d'un graphique
La solubilité peut être évaluée en interprétant un graphique. Pour ce faire, déterminez simplement la température, tournez-la vers la courbe puis tournez la courbe vers l'axe des y, qui est la masse en grammes de soluté qui sera dissous.
Exemple: (UFTM - adapté) Le graphique montre la courbe de solubilité d'un sel d'AX2.
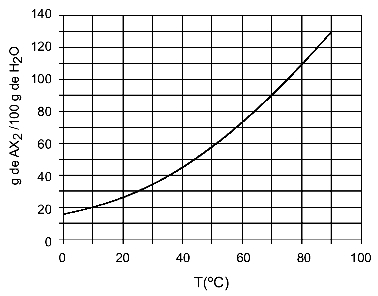
Le graphique indique que, sur l'axe des y, la quantité d'eau (solvant) est de 100 grammes. Pour soluté AX2, nous déterminerons la quantité d'eau aux températures suivantes :
30OÇ : Quand on allume la température 30OC à la courbe puis la courbe à l'axe des y, on a qu'à cette température, les 100 grammes d'eau peuvent dissoudre environ 35 grammes de soluté AX2.
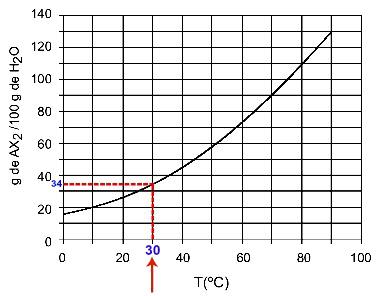
Détermination de la solubilité de l'AX2 à 30 ansOÇ
40OÇ : Quand on allume la température 40OC à la courbe puis la courbe à l'axe des y, on a qu'à cette température, les 100 grammes d'eau peuvent dissoudre environ 45 grammes de soluté AX2.
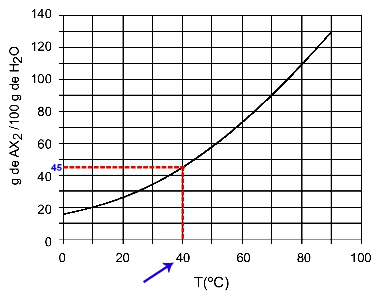
Détermination de la solubilité de l'AX2 à 40 ansOÇ
Comme la quantité dissoute de soluté est plus grande à chaque augmentation de température, nous avons que l'AX2 c'est un soluté endothermique.
c) interprétation textuelle
Voir l'exemple suivant :
Exemple: (PUC-MG) Certaines substances sont capables de former des mélanges homogènes avec d'autres substances. La substance qui est en plus grande quantité s'appelle un solvant et celle qui est en plus petite quantité s'appelle un soluté. Le chlorure de sodium (NaCl) forme une solution homogène avec l'eau, dans laquelle il est possible de solubiliser, à 20ºC, 36 g de NaCl dans 100 g d'eau.
Le texte précise que si nous avons 100 grammes d'eau (solvant), à une température de 20 OC, il est possible de dissoudre jusqu'à 36 grammes de NaCl.
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm

