L'aluminium est obtenu par des procédés métallurgiques. La métallurgie est un domaine qui étudie la transformation des minerais en métaux ou alliages métalliques. Plusieurs métaux sont obtenus par cette méthode, comme le cuivre, le titane, le fer et le manganèse.
Dans le cas de l'aluminium, le principal minerai utilisé est le bauxite (figure), qui contient de l'oxyde d'aluminium hydraté (Aℓ2O3. x H2O) et diverses impuretés.

Dans la métallurgie de l'aluminium, les quatre étapes suivantes se produisent :
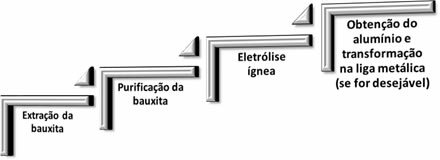
Lorsque l'oxyde d'aluminium (Aℓ2O3(s)) est séparé de la bauxite, son nom devient alumine.
Auparavant, ce qui suit était fait: l'alumine était traitée avec de l'acide chlorhydrique pour générer du chlorure d'aluminium; qui a été mis à réagir avec du potassium ou du sodium métallique, provoquant la réduction du composé et donnant naissance à de l'aluminium métallique :
Aℓ2O3(s) + 6 HCℓ(ici)→ 4 AℓCℓ3(aq) + 3H2O(ℓ)
ACℓ3(aq) + 3K(s)→ 3 KCℓ(s) + Aℓ(s)
Cependant, cette méthode était très coûteuse et inefficace, de sorte que l'aluminium était considéré comme un métal rare.
Mais en 1886, deux scientifiques ont développé séparément la méthode mentionnée ci-dessus, dans laquelle l'électrolyse ignée a été utilisée. Ces scientifiques étaient l'Américain Charles M. Hall et le Français Paul Héroult, c'est ainsi que cette méthode a été appelée Procédé Hall-Héroult ou simplement,Processus de salle, tandis que Charles M. Hall l'a breveté.
Le point clé qu'ils ont découvert était de savoir comment faire de l'oxyde d'aluminium liquide pour le faire. être en mesure d'effectuer son électrolyse ignée, car le problème était que son point de fusion était supérieur 2000°C. Ils ont utilisé un fondant, du minerai de cryolite (Na3AℓF6), qui a pu abaisser la température de fusion de l'oxyde d'aluminium à environ 1000 °C.
Ainsi, comme le montre le schéma ci-dessous, ce mélange d'oxyde d'aluminium et de cryolithe a été placé dans une cuve d'électrolyse en acier revêtue de carbone. Un courant électrique traverse ce mélange fondu. Les parois du récipient qui sont en contact avec le mélange agissent comme un pôle négatif d'électrolyse (cathode), où se produit la réduction des cations aluminium. Les anodes (pôle positif) sont des cylindres en graphite ou en carbone, c'est-à-dire tous deux en carbone, où se produit l'oxydation des anions oxygène :
Demi-réaction cathodique: 4 Aℓ3+(ℓ) + 12 et- → 4 Aℓ(ℓ)
Demi-réaction d'anode: 6 O2-(ℓ) → 12 et- + 3O2(g)
L'oxygène formé réagit avec le carbone dans l'anode et génère également du dioxyde de carbone :
3 heures2(g) + 3C(s) → 3 CO2(g)
Ainsi, la réaction globale et le schéma de cette électrolyse ignée qui donne naissance à l'aluminium sont donnés par :

L'aluminium obtenu est sous forme liquide, car son point de fusion est de 660,37 ºC, c'est-à-dire inférieur à celui d'un mélange d'alumine et de cryolithe. L'aluminium est également plus dense que le mélange et, par conséquent, il se dépose au fond du récipient, où il est collecté.
Dans la production de 1 tonne d'aluminium, il est utilisé :
- 4 à 5 tonnes de bauxite, d'où environ 2 tonnes d'alumine;
- 50 kilogrammes de cryolite (il n'y a pas beaucoup de réserves naturelles de cryolithe, par conséquent, elle est généralement obtenue grâce à sa synthèse à partir de fluorite (CaF2), un minéral le plus abondant dans la nature);
- 0,6 tonne de charbon pour les électrodes.
Chaque année, la production d'aluminium dépasse 27,4 millions de tonnes.
Parmi les principaux alliages d'aluminium, nous avons les suivants :

Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/obtencao-aluminio-por-meio-eletrolise.htm

