À piles ordinaires sont appelés Piles Leclanché du nom de son inventeur, le chimiste français George Leclanché (1839-1882).

Georges Leclanché (1839-1882)
Leclanché a créé ce type de batterie en 1866. Elle s'appelle aussi pile sèche car jusque là il n'y avait que des batteries qui utilisaient des solutions aqueuses, comme Le tas de Daniell.
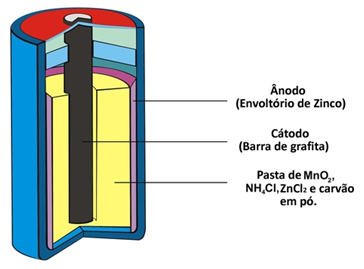
Deux autres noms que ce type de pile reçoit en raison de sa constitution sont tas d'acide ou alors pile zinc-carbone. Il est essentiellement constitué d'une enveloppe de zinc séparée des autres espèces chimiques qui composent le tas au moyen d'un papier poreux.
Ce zinc correspond au pôle négatif de la pile ou de l'anode, au fur et à mesure qu'il s'oxyde en perdant deux électrons, selon la semi-réaction ci-dessous :
Pôle négatif - Anode: Zn (s) → Zn2+(ici) + 2 et-
Cette pile possède également un pôle positif, la cathode, qui est une barre de graphite installée au milieu de la pile entourée de dioxyde de manganèse (MnO2), du charbon en poudre (C) et une pâte humide contenant du chlorure d'ammonium (NH4Cl), chlorure de zinc (ZnCl2) et de l'eau (H2O).
Le chlorure d'ammonium et le chlorure de zinc sont des sels à caractère acide, d'où le nom de « cellule acide ».
La barre de graphite conduit les électrons perdus par le zinc en manganèse, réduisant ainsi le dioxyde de manganèse (MnO)2) en trioxyde de manganèse (Mn2O3), selon la semi-réaction suivante :
Pôle positif - Cathode: 2 MnO2(aq) + 2 NH41+(ici) + 2e- → 1Mn2O3(s) + 2NH3(g) + 1 heure2O(1)
La pâte humide agit comme un point de sel, permettant la migration des anions hydroxyles (OH-) du graphite au zinc.
La réaction globale est donnée par :
Zn (s) + 2 MnO2(aq) + 2 NH41+(ici) → Zn2+(ici) + 1 mn2O3(s) + 2NH3(g)
En tant que telles, ces batteries ne sont pas rechargeables car tout le dioxyde de manganèse est converti en trioxyde de manganèse. Lorsque la batterie cesse de fonctionner, elle doit être jetée.
Le ddp de ces batteries est de 1.5V. Cependant, l'ammoniac (NH3(g)) formé à la cathode peut se déposer sur le barreau de graphite, entravant le passage des électrons et diminuant la tension de la batterie. Pour revenir à un fonctionnement normal, il suffit de laisser reposer la batterie à l'extérieur de l'appareil, car le cation zinc (Zn2+(ici)) formé à l'anode réagit avec l'ammoniac, laissant le barreau de graphite libre.
De plus, placer le tas au réfrigérateur peut également aider, car l'abaissement de la température favorise la solubilité de l'ammoniac dans la pâte humide du tas.
Un autre facteur important concernant les cellules sèches Leclanché que nous devons considérer est que le boîtier en zinc peut se corroder et ainsi laisser échapper le matériau corrosif et endommager l'appareil.. Par conséquent, la meilleure chose à faire est de ne pas laisser les batteries à l'intérieur d'appareils qui ne sont pas utilisés en permanence.
Les piles sèches sont indiquées pour les équipements nécessitant une décharge légère et continue, tels que les télécommandes, les horloges murales, les radios portables et les jouets.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/pilha-seca-leclanche.htm

