Apprenez à appliquer la première loi de la thermodynamique dans différentes situations, résolvez des exercices et testez vos connaissances avec des exercices résolus et expliqués.
question 1
La première loi de la thermodynamique stipule que :
a) L'énergie ne peut pas être créée ou détruite, mais elle peut être convertie d'une forme à une autre.
b) L'énergie est toujours conservée, mais elle ne peut pas être convertie d'une forme à une autre.
c) L'énergie peut être créée ou détruite, mais elle ne peut pas être convertie d'une forme à une autre.
d) L'énergie ne peut pas être conservée, mais elle peut être convertie d'une forme à une autre.
La première loi de la thermodynamique est le principe de conservation de l'énergie, donc dans un système fermée, la quantité d'énergie reste constante et ne peut être transformée que d'une forme à une autre. autre.
question 2
Supposons un système fermé qui reçoit 100 J de chaleur tout en effectuant 50 J de travail. Quelle est la variation de l'énergie interne du système ?
a) -50J
b) 0J
c) 50J
d) 100J
e) 150J
Vérification des signes :
La chaleur reçue est positive Q > 0.
Le travail effectué est positif W > 0.
D'après la première loi, on a :
question 3
Un système de gaz parfait échange 500 joules de chaleur avec le milieu extérieur. En supposant que ce processus soit un refroidissement isométrique, déterminez respectivement le travail et l'énergie interne.
a) 500 J et 0 J
b) - 500 et 0J
c) 0 J et 500 J
d) 0 J et - 500 J
e) -500 J et 500 J
Comme le processus est isométrique, il n'y a pas de changement de volume, donc le travail est nul.
Selon la première loi de la thermodynamique :
Comme il s'agit d'un refroidissement, le système perd de la chaleur, donc :
question 4
8 moles d'un gaz parfait dans un système piston-cylindre sont comprimées en faisant 1000 J de travail. Au cours du processus, 400 J de chaleur sont perdus vers l'environnement extérieur. Son énergie interne et la variation de sa température sont respectivement égales à
Soit: R = 8,31 J/mol. K
a) - 1400 J et variation approximative de 6 K
b) 600 J et variation approximative de 6 K
c) 600 J et variation approximative de 14 K
d) - 1400 J et variation approximative de 14 K
énergie interne
Lorsque le système reçoit du travail, son signe est négatif, ainsi que la chaleur qui, dans ce processus, est perdue.
La première loi de la thermodynamique est la suivante :
En substituant les valeurs, on obtient :
R = 8,31 J/mol·K
Température
D'après la loi de Joule, on a :
question 5
Un gaz parfait subit une compression, faisant 500 J de travail. A la fin de cette transformation, l'énergie interne du système a changé de 200 J de moins qu'au début. La quantité de chaleur échangée par le gaz était
a) - 700J
b) - 300J
c) 300J
d) 0J
e) 700J
Puisque le travail a été reçu, c'est-à-dire un travail résistant, son signe est négatif.
Substituant les valeurs dans l'équation de la première loi de la thermodynamique:
question 6
(CEDERJ 2021) Dans une étape du cycle exécuté par un gaz parfait dans un climatiseur, la pression du gaz est augmentée en gardant son volume constant. A ce stade du cycle, le travail W effectué par le gaz, la quantité de chaleur Q absorbée par celui-ci et la variation ΔT de sa température sont respectivement :
a) W < 0, Q < 0 et ΔT < 0
b) W = 0, Q > 0 et ΔT > 0
c) W = 0, Q = 0 et ΔT = 0
d) W > 0, Q > 0 et ∆T > 0
Données:
La pression P augmente ;
Le volume reste constant ;
Travail
Comme le volume est constant, le travail W est égal à zéro.
Voici la première loi de la thermodynamique :
Puisque la chaleur est positive, la variation de l'énergie interne sera également positive.
Chaleur
Puisque la chaleur est absorbée, elle est positive.
Température
Par la loi des gaz :
Où,
n est le nombre de moles
R est la constante universelle des gaz
Ainsi, la température ne dépend que de la pression, puisque le volume est constant, étant positif.
question 7
(UNICENTRO 2018) Selon la première loi de la thermodynamique, la variation de l'énergie interne d'un système, ΔU, est donné par la différence entre la chaleur échangée avec l'environnement extérieur, Q, et le travail, W, effectué dans le processus thermodynamique. Compte tenu de ces informations, si un gaz monoatomique se dilate de manière à rester toujours à la même température, cette transformation peut être représentée par l'équation
a) ΔU + W = 0
b) ΔU − W =0
c) Q - W = 0
d) Q + ΔU = 0
Le processus isotherme se produit sans changement de température.
L'énergie est liée à la température par :
Où n est le nombre de moles et R est la constante universelle des gaz. Puisque n et R sont constants, il n'y a qu'une variation de température, et
Voici la première loi de la thermodynamique :
question 8
(URCA 2016) Selon la première loi de la thermodynamique si, lors d'un processus isotherme subi par un gaz parfait de masse fixe, le gaz libère une quantité de chaleur dont l'amplitude est de 50 cal alors le changement d'énergie interne et le travail effectué par le gaz dans ce processus sont, respectivement:
a) 0 et 50 cal.
b) 50 cal et 0.
c) 0 et 0.
d) 50 cal et -50 cal.
e) 0 et -50 cal.
Le changement d'énergie interne est directement lié au changement de température. Comme le processus est isotherme, il n'y a pas de changement de température, donc .
De la première loi de la thermodynamique :
Puisque de la chaleur est dégagée, son signe est négatif.
question 9
(UFRN 2012) La biomasse est l'une des principales sources d'énergie renouvelable et, par conséquent, les machines qui l'utilisent comme carburant pour la production d'électricité sont importantes d'un point de vue environnemental. Un exemple très courant est l'utilisation de la biomasse pour entraîner une turbine à vapeur afin de générer du travail. La figure ci-contre montre schématiquement une centrale thermoélectrique simplifiée.
Dans cette centrale thermoélectrique, la combustion de la biomasse dans le four produit de la chaleur, qui chauffe l'eau de la chaudière et génère de la vapeur à haute pression. La vapeur, à son tour, est conduite par des tuyaux jusqu'à la turbine qui, sous son action, commence à faire tourner ses pales.
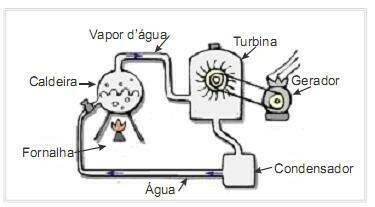
Supposons que les pertes de chaleur dues aux différences de température entre les pièces de ce moteur thermique et l'environnement soient négligeables. Dans ce contexte, la variation de l'énergie interne de l'eau de chaudière
a) est supérieur à la somme de la chaleur qui lui est fournie par la combustion de la biomasse et du travail effectué sur la turbine.
b) est égal à la somme de la chaleur qui lui est fournie par la combustion de la biomasse avec le travail effectué sur la turbine.
c) est égal à la différence entre la chaleur qui lui est fournie par la combustion de la biomasse et le travail effectué sur la turbine.
d) est supérieur à la différence entre la chaleur qui lui est fournie par la combustion de la biomasse et le travail effectué sur la turbine.
L'eau de la chaudière reçoit de l'énergie sous forme de chaleur provenant de la combustion du combustible et libère de l'énergie sous forme de travail effectué sur la turbine.
questions 10
(UECE 2021) Concernant les propriétés des gaz, faites attention aux déclarations suivantes :
je. Pour un gaz parfait, l'énergie interne est uniquement fonction de la pression.
II. La chaleur absorbée par un gaz lors d'un changement d'état est indépendante du processus.
III. L'énergie interne d'un gaz parfait dépend uniquement de la température et est indépendante du processus.
IV. Dans une détente isotherme d'un gaz parfait, le travail effectué par celui-ci est égal à la chaleur absorbée.
C'est correct ce qui est dit seulement dans
a) I et II.
b) III et IV.
c) I et IV.
d) II et III.
III. CORRECT. L'énergie interne d'un gaz parfait dépend uniquement de la température et est indépendante du processus.
Le changement d'énergie interne est directement lié au changement de température.
Où n est le nombre de moles et R est la constante du gaz idéal, étant des constantes, seule la température détermine l'énergie interne du gaz.
IV. CORRECT. Dans une détente isotherme d'un gaz parfait, le travail effectué par celui-ci est égal à la chaleur absorbée.
Puisqu'il est isotherme, il n'y a pas de changement de température, donc le changement d'énergie interne est nul. Par la première loi de la thermodynamique :
En savoir plus avec :
- Première loi de la thermodynamique
- Thermodynamique: lois, concepts, formules et exercices
- Exercices sur la thermodynamique
- loi gaz
ASTH, Raphaël. Exercices de la première loi de la thermodynamique.Tout compte, [s.d.]. Disponible en: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Accès à:
Voir aussi
- Exercices sur la thermodynamique
- Thermodynamique
- transformation adiabatique
- Exercices sur la thermochimie
- Première loi de la thermodynamique
- Sciences naturelles et leurs technologies: Enem
- L'énérgie thermique
- Deuxième loi de la thermodynamique

