Au fonctions oxygène sont un groupe de composés organiques qui ont des atomes d'oxygène attachés à la chaîne carbonée. Sont-ils:
alcool;
cétone;
aldéhyde;
acide carboxylique;
ester;
éther.
A lire aussi :Hydrocarbures — composés constitués de carbone et d'hydrogène
Résumé sur la fonction de l'oxygène
Les fonctions oxygène sont un groupe de composés qui contiennent un atome d'oxygène. oxygène attaché directement à la chaîne carbonée.
Les différentes fonctions de l'oxygène sont caractérisées par un arrangement structurel spécifique de atomes, appelé groupe fonctionnel.
Les groupes fonctionnels sont responsables des propriétés de chaque fonction organique.
Les fonctions oxygénées sont: alcool, cétone, aldéhyde, acide carboxylique, ester et éther.
Leçon vidéo sur la fonction oxygène
Quelles sont les fonctions de l'oxygène ?
Les fonctions corporelles oxygénées sont celles qui avoir un atome d'oxygène lié à un atome d'oxygène carbone de la chaîne carbonée.
Les fonctions de l'oxygène sont :
alcool;
cétone;
aldéhyde;
acide carboxylique;
ester;
éther.
Les fonctions organiques sont identifiés par leur groupe fonctionnel, qui est un arrangement structurel d'atomes ou de liaisons, responsable des propriétés caractéristiques de cet ensemble de composés.
Importance des fonctions de l'oxygène
La présence de fonctions oxygène dans les composés organiques est capable de modifier les propriétés des composés, par rapport à l'hydrocarbure respectif, avec un nombre égal de carbones.
Les fonctions oxygène sont caractérisées par la présence de groupements hydroxyle, carbonyle ou carboxyle. UN la présence de l'atome d'oxygène augmente le caractère polaire composés, les rendant plus hydrophiles, c'est-à-dire augmentant leur affinité pour eau.
Apparition des fonctions de l'oxygène est également responsable du type de force intermoléculaireagissant entre les molécules. La nature et l'intensité des forces intermoléculaires affectent la solubilité et les températures de fusion et d'ébullition.
Le tableau ci-dessous apporte une comparaison entre quelques propriétés de trois composés qui ont le même nombre d'atomes de carbone, mais diffèrent par la présence de groupes fonctionnels oxygénés.
Compost organique | |||
Butane (C4H10) |
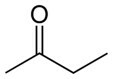
Butanone (C4H8O) |
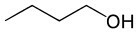
Butanol (C4H10O) |
|
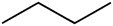 |
 |
 |
|
fonction organique |
Hydrocarbure |
cétone (fonction oxygène) |
Alcool (fonction oxygène) |
Polarité |
apolaire |
Polaire |
Polaire |
température de fusion |
-138.3°C |
-86°C |
-89°C |
température d'ébullition |
-0.5°C |
80°C |
118°C |
Force intermoléculaire prédominante |
Dipôle induit |
dipôle permanent |
liaisons hydrogène |
Alcool
L'alcool à fonction organique a un groupe hydroxyle (-OH) lié directement au carbone saturé, c'est-à-dire cet atome de carbone qui n'établit que des liaisons simples.
Groupe fonctionnel des alcools: R-OH (hydroxyle).
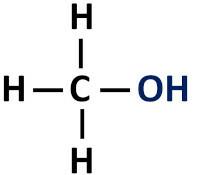
les alcools sont classés selon le type de carbone auquel l'hydroxyle est attaché. Les alcools primaires ont l'hydroxyle attaché au carbone primaire. Les alcools secondaires ont le groupe hydroxyle attaché à un carbone secondaire, et les alcools tertiaires ont leur groupe -OH attaché aux carbones tertiaires.
Un composé organique qui n'a qu'un seul hydroxyle est appelé un monoalcool. S'il a deux groupes hydroxyle, on l'appelle un dialcool. Au-dessus, les molécules sont appelées polyalcools.
UN nomenclature des alcools suit la recommandation de l'Iupac (Union Internationale de Chimie Pure et Appliquée), considérant l'assemblage du nom des structures chimiques en trois parties :
Préfixe - lié au nombre de carbones.
Infixe - fait référence au type de liaison chimique établie entre les atomes de carbone.
Suffixe – lié au groupe fonctionnel. Dans le cas des alcools, le suffixe utilisé est -Bonjour.
Voir exemples :
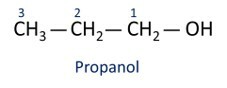
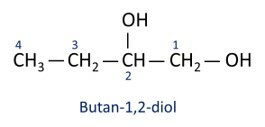
O l'alcool principal est éthaneje (CH3CH2OH), utilisé comme carburant, dans les boissons alcoolisées, comme solvant chimique, agent de nettoyage et désinfectant.
cétone
La fonction cétone organique correspond à la groupe fonctionnel carbonyle (C=O), situé entre deux atomes de carbone de la chaîne carbonée.
Groupe fonctionnel des cétones: R1–(C=O)–R2.

Les cétones sont classés selon le nombre de groupes carbonyle:
Monocétones - ont un seul groupe carbonyle.
Dicétones - ont deux groupes carbonyle.
Polytones - ont plus de deux groupes carbonyle.
UN nomenclature des cétones suit les règles Iupac, mais avec une différence dans l'orthographe du suffixe. Les cétones sont identifiées par le suffixe -sur un.
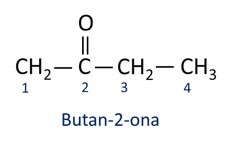
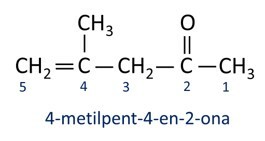
En général, les cétones trouvent une application dans la fabrication d'autres produits chimiques et pharmaceutiques. Dans l'industrie, les cétones sont utilisées comme solvants pour les peintures, les teintures et les vernis. L'une des cétones les plus connues est propanone, qui est populairement connu sous le nom d'acétone. Les solutions d'acétone sont utilisées pour enlever le vernis à ongles.
A lire aussi :Amides - composés qui ont un azote attaché au carbonyle
Aldéhyde
La fonction aldéhyde organique est caractérisé par la présence de la fonction carbonyle, dont l'atome de carbone possède une liaison hydrogène.
Groupe fonctionnel des aldéhydes: H–C=O (formyle).
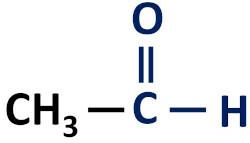
Les aldéhydes se trouvent toujours à la fin des chaînes carbonées car leur atome de carbone doit être lié à au moins un atome d'hydrogène.
UN nomenclature des composés aldéhydiques suit les règles IUPAC, différant par le suffixe. Les aldéhydes sont identifiés par le suffixe -Al.
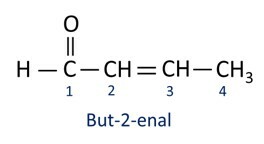
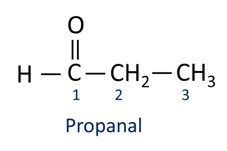
Les aldéhydes sont utilisés industriellement dans la fabrication de parfums et arôme, car son odeur et sa saveur varient selon la longueur de la chaîne carbonée. Les composés aldéhydiques sont également utilisés dans la fabrication de produits de nettoyage, de médicaments, de polymères, entre autres. Les aldéhydes à chaîne carbonée courte peuvent être utilisés comme agent de conservation, comme le célèbre formol, qui est un aldéhyde nommé méthanal.

acide carboxylique
La fonction acide carboxylique organique est identifiée par la présence de la fonction carboxyle (-COOH).
Groupe fonctionnel des acides carboxyliques: –(C=O)OH ou –COOH.

Les composés appartenant à cette fonction organique sont des acides faibles, car ils libèrent facilement des ions H+ en solution aqueuse.
UN nomenclature des acides carboxyliques suit les règles de l'Iupac, cependant le terme "acide" apparaît avant le préfixe qui indique le nombre de carbone, et le suffixe utilisé est -oic.
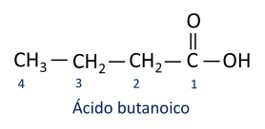
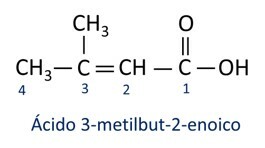
O l'acide carboxylique le plus courant dans la vie quotidienne est le Acide acétique, substance présente dans le vinaigre. La vitamine C, abondante dans de nombreux agrumes, est une molécule organique appelée acide ascorbique.
Ester
La fonction ester organique est identifié par la présence de la fonction carbonyle, dont l'atome de carbone a un ligand oxygène.
Groupe fonctionnel des esters: –R–(C=O)O–R'.
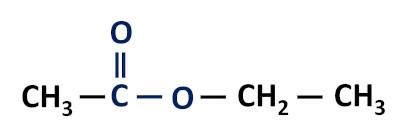
Les esters sont dérivés d'acides carboxyliques, différant de ceux-ci en ce qu'ils ont un radical alkyle attaché à l'atome d'oxygène au lieu de l'atome d'hydrogène.
Les molécules appartenant à la fonction ester sont formées par la réaction entre un acide carboxylique et un alcool, réaction connue sous le nom de estérification.
Les règles pour nomenclature des esters définis par Iupac considèrent que la molécule est formée de deux parties :
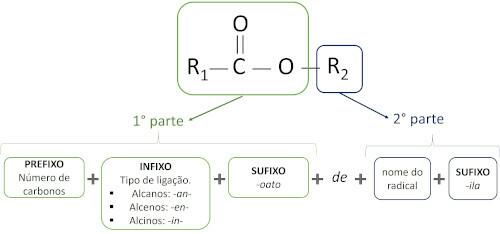
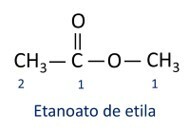
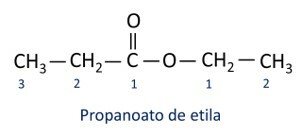
La principale caractéristique des esters est leur capacité à simuler le goût et l'arôme des aliments naturels, selon la longueur des chaînes carbonées (R1 et R2). Pour cette raison, les esters sont largement utilisés comme agents aromatisants dans l'industrie alimentaire, dans la production de produits pharmaceutiques, de parfums et de cosmétiques.
Éther
La fonction organique de l'éther est caractérisé par la présence d'un atome d'oxygène entre deux chaînes carbonées.
Groupe fonctionnel des éthers: R–O–R.

Les éthers sont des substances hautement inflammables, avec une odeur caractéristique et forte.
UN nomenclature officielle Iupac pour les éthers suit l'ordre préfixe + infixe + suffixe. Cependant, le côté de la molécule qui a moins de carbones reçoit le suffixe -oxy tandis que la chaîne carbonée la plus longue est nommée comme s'il s'agissait d'un hydrocarbure, recevant le suffixe -o.
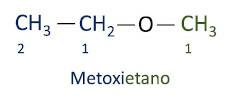
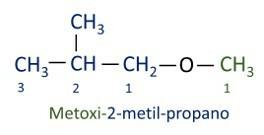
Les éthers sont utilisé comme solvant pour les peintures, les résines, les huiles et les graisses. De ce fait, ils sont utilisés dans différents procédés industriels et pharmaceutiques. L'éther était autrefois utilisé comme anesthésique, remplacé par d'autres substances plus sûres de nos jours.
A lire aussi :Composés nitrés — composés qui contiennent des groupes nitro (NO2) dans leur molécule
Exercices résolus sur les fonctions de l'oxygène
question 1
(Uece) En chimie organique, un groupe fonctionnel est défini comme une structure moléculaire qui confère aux substances un comportement chimique similaire. L'ensemble des composés qui ont le même groupe fonctionnel est appelé fonction organique. Cochez l'option qui présente correctement le composé et la fonction organique à laquelle il appartient.

Résolution:
Lettre C
Parmi les alternatives, la seule qui exprime correctement le groupe fonctionnel au nom de la fonction chimique est l'item C. La fonction ester organique est définie par la fonction carbonyle, dont l'atome de carbone possède également un ligand oxygène.
Dans le point A, le groupe fonctionnel éther est exprimé.
Dans le point B, la fonction cétone est exprimée.
Dans le point D, la fonction amide est exprimée. amines C'est amides appartiennent aux fonctions azotées.
question 2
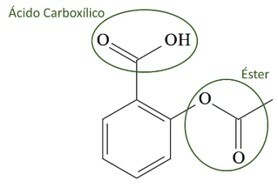
(UCS-RS) Au Ve siècle av. C., Hippocrate, médecin grec, a écrit qu'un produit à base d'écorce de saule soulageait la douleur et faisait baisser la fièvre. Ce même produit, une poudre acide, est même mentionné dans les textes des anciennes civilisations du Moyen-Orient, de Sumer, d'Egypte et d'Assyrie. Les Amérindiens l'utilisaient également contre les maux de tête, la fièvre, les rhumatismes et les tremblements. Ce médicament est un précurseur de l'aspirine, dont la structure chimique est présentée ci-dessous.
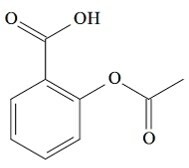
Les fonctions organiques présentes dans la structure de l'aspirine, représentées ci-dessus, sont :
a) acide carboxylique et ester.
b) alcool et éther.
c) amine et amide.
d) amine et éther.
e) acide aminé et alcool.
Résolution:
Lettre a
Par Ana Luiza Lorenzen Lima
Professeur de chimie
Source: École du Brésil - https://brasilescola.uol.com.br/quimica/funcoes-oxigenadas.htm

