Le scientifique Friedrich Kohlrausch (1840-1910) a été le premier à proposer que l'eau pure conduise l'électricité, bien qu'à petite échelle. C'est parce que l'eau se comporte de manière amphotère; c'est-à-dire qu'à certaines occasions, il agit comme un acide, en donnant des protons (H+); et dans d'autres, il se comporte comme une base, recevant des protons.
Cela signifie que l'eau effectue sa propre ionisation, selon l'équation chimique ci-dessous :
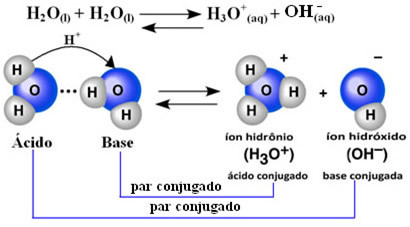
Ce processus est appelé auto-ionisation de l'eau et cela se produit à très petite échelle, c'est-à-dire que l'eau est un électrolyte très faible, avec de faibles valeurs de degré d'ionisation et une constante d'ionisation à l'équilibre (Kç). C'est exactement pourquoi l'eau a une conductivité si faible.
Pour se faire une idée, à une température ambiante de 25°C il est possible de déterminer que les concentrations en ions hydroxyde et hydronium produits lors de l'auto-ionisation de l'eau pure sont égales à 1. 10-7 mol. L-1. Cela signifie que sur un milliard de molécules d'eau, seules deux s'ionisent.
La constante d'équilibre ionique de l'eau est appelée çconstante de dissociation de l'eau,constante d'autoprotolyseou alors produit ionique de l'eau.Cette constante est représentée par Kw, car le w fait référence au mot l'eau, qui en anglais signifie eau.
Son calcul se fait de la même manière que les autres constantes d'équilibre, en rappelant que, comme indiqué dans le texte "Constantes de Balance Kc et Kp", dans ce cas, seuls les produits apparaîtront dans l'expression, car l'eau à l'état liquide a la même activité à 1. Les substances liquides ou solides pures ne sont pas mises dans l'expression de la constante de dissociation car elles ne changent pas. Seules des solutions aqueuses et gazeuses sont mises en place. Donc nous avons:
Kw = [H3O+]. [Oh-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
Comme pour les autres constantes d'équilibre, d'accordw il ne change qu'avec le changement de température. À mesure que la température de l'eau augmente, son ionisation augmente également, ce qui signifie que l'auto-ionisation de l'eau est un processus endothermique, c'est-à-dire qu'elle absorbe de la chaleur.
Cela peut être vu dans les valeurs du produit ionique de l'eau (Kw) donnés dans le tableau ci-dessous à différentes températures :
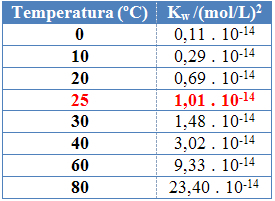
Le produit ionique de l'eau aura toujours une valeur fixe à chaque température, que ce soit dans l'eau pure ou en solution. Même si la solution a des concentrations d'ions H3O+ et oh- différent, le produit entre eux restera constant.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm
