LA la batterie est un système où se produit la réaction d'oxydo-réduction. Dans ce dispositif, l'énergie chimique produite lors de la réaction spontanée est convertie en énergie électrique.
Les réactions d'oxydation et de réduction se produisent simultanément dans une cellule. Lorsqu'une espèce subit une oxydation, elle donne des électrons à l'autre espèce qui, en les recevant, subit une réduction.
Par conséquent, celui qui subit l'oxydation est l'agent réducteur et celui qui subit la réduction est l'agent oxydant.
LA oxydation se produit lorsqu'une espèce perd des électrons et devient un cation: A → A+ + et-.
LA réduction se produit lorsqu'une espèce gagne des électrons et devient électriquement neutre: B+ + et- → B
Dans les équations chimiques, ce transfert d'électrons est démontré par le changement du nombre d'oxydation (nox).
Des réactions de réduction se produisent à l'intérieur des cellules et le courant électrique se produit avec la migration des électrons du pôle négatif vers le pôle positif.

Comment fonctionne une pile ?
Une réaction redox peut généralement être représenté par l'équation :
A + B+ → Un+ +B
Où,
A: substance qui s'oxyde, perd des électrons, augmente sa valeur et est l'agent réducteur.
B: substance qui subit une réduction, gagne des électrons, diminue l'oxydation et est l'agent oxydant.
Voyez dans l'image suivante comment ce processus peut être représenté.
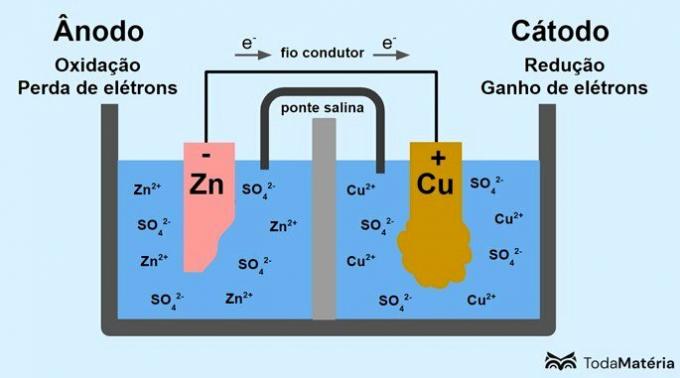
Le système divisé en deux semi-cellules et formé de deux électrodes métalliques reliées extérieurement par un fil conducteur a été développé par John Frederic Daniell (1790-1845) en 1836.
La batterie est constituée de deux électrodes, reliées par un fil conducteur, et d'un électrolyte, où se trouvent les ions. L'électrode est la surface conductrice solide qui permet l'échange d'électrons.
anode: électrode au niveau de laquelle se produit l'oxydation. C'est aussi le pôle négatif de la batterie.
Cathode: électrode à laquelle se produit la réduction. C'est aussi le pôle positif de la batterie.
Dans l'image ci-dessus, le zinc métallique est l'anode et subit la oxydation. Le cuivre métallique est la cathode et subit une réduction. La migration des électrons (e-) se produit de l'anode vers la cathode à travers le fil conducteur.
Les réactions qui se produisent dans le système d'image sont :
- anode (oxydation): Zn(s) → Zn2(ici) + 2e-
- Cathode (réduction): Cu2+(ici) + 2e- → cul(s)
- équation générale:Zn(s) + cul2+(ici) → cul(s) +Zn2+(ici)
Le zinc est un métal ayant une plus grande tendance à perdre des électrons et, par conséquent, des cations se forment dans la solution. L'électrode de zinc commence à s'user et à perdre de la masse car le zinc est libéré dans la solution lors de la formation de cations Zn2+.
Les électrons de l'anode arrivent à la cathode et les cations métalliques, en les recevant, se transforment en cuivre métallique qui se dépose sur l'électrode et augmente sa masse.
Le pont salin est un courant ionique responsable de la circulation des ions dans le système pour le maintenir électriquement neutre.
A lire aussi indice d'oxydation (nox).
type de batterie
Dans une cellule, la tendance des espèces chimiques à recevoir ou à donner des électrons est déterminée par le potentiel de réduction.
Le composant avec le potentiel de réduction le plus élevé a tendance à subir une réduction, c'est-à-dire à gagner des électrons. L'espèce ayant le potentiel de réduction le plus faible et, par conséquent, le potentiel d'oxydation le plus élevé, a tendance à transférer des électrons.
Par exemple, dans la réaction redox Zn0(s) + cul2+(ici) → cul0(s) +Zn2+(ici)
Le zinc s'oxyde et donne des électrons car il a un potentiel de réduction E0 = -0.76V, inférieur au potentiel de réduction du cuivre E0 = +0,34V et, par conséquent, il reçoit des électrons et subit une réduction.
Voir ci-dessous pour d'autres exemples de piles.
Pile de zinc et d'hydrogène
Demi-réaction d'oxydation: Zn(s) → Zn2+ + 2e- (ET0 = -0.76V)
Demi-réaction de réduction: 2H+(ici) + 2e- → H2(g) (ET0 =0.00V)
Équation globale: Zn(s) + 2H+(ici) → Zn2+(ici) +H2(g)
Représentation de la pile:
Cuivre et pile à hydrogène
Demi-réaction d'oxydation: H2(g) → 2H+(ici) + 2e- (ET0 = 0.00V)
Demi-réaction de réduction: Cu2+(ici) + 2e- → cul(s) (ET0 = +0.34V)
Équation globale: Cu2+(ici) +H2(g) → 2H+(ici) + cul(s)
Représentation de la pile:
Obtenez plus de connaissances sur le sujet avec le contenu :
- électrochimie
- Électrolyse
Références bibliographiques
FONSECA, M. R M Chimie, 2. 1. éd. São Paulo: Attique, 2013.
SANTOS, W.L.P; MOL, G. S. Chimie citoyenne, 3. 2. éd. São Paulo: Editora AJS, 2013.
USBERCO, J. Connectez la chimie, 2: chimie. - 2. éd. São Paulo: Saraiva, 2014.



