Comme expliqué dans le texte "Catalyse et catalyseur», les catalyseurs sont des espèces chimiques qui accélèrent la vitesse des réactions. Son utilisation est très utile dans les industries chimiques, où l'on cherche à gagner le plus de temps possible dans la production.
Cependant, dans certaines situations, il est plus intéressant que la réaction se déroule plus lentement; comme, par exemple, lorsque vous voulez déterminer la vitesse de réactions très rapides. Pour réaliser cet exploit, en contrôlant et en étudiant ces réactions, il est d'usage d'ajouter une substance qui ralentit les réactions, que l'on appelle inhibiteurs, poisons ou alors anticatalyseurs.
Ces espèces chimiques se combinent avec le catalyseur, annulant ou diminuant son action. Ceci est possible car le mécanisme d'action du catalyseur est de diminuer l'énergie d'activation, facilitant le processus de réaction et augmentant sa vitesse; déjà les inhibiteurs agissent en sens inverse, ce qui signifie qu'ils augmentent l'énergie d'activation nécessaire aux réactifs pour atteindre le complexe activé.
A titre d'exemple, on peut citer l'arsenic (As), qui a cette fonction dans la réaction de Haber-Bosch, réaction largement utilisée dans l'industrie pour la production d'ammoniac, à partir de fer (Fe(s)) comme catalyseur. Ainsi, l'efficacité du fer devient très faible en présence d'arsenic, ce qui l'inhibe, c'est-à-dire qu'il est le poison catalytique de cette réaction, qui est montré ci-dessous :
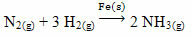
L'arsenic peut également exercer une action anti-catalytique lors de l'utilisation de platine métallique (Pt(s)) comme catalyseur pour la réaction de combustion du SO2(g), pour la production de trioxyde de soufre (SO3(g)). La présence d'arsenic, même en faible quantité, annule l'action catalytique du platine, ce qui peut paralyser une partie de la production. C'est pourquoi, normalement, dans les industries qui traitent cette production, le pentoxyde de divanadium est utilisé (V2O5(s)) comme catalyseur à la place du platine.
Un autre exemple se produit dans la réaction de décomposition du peroxyde d'hydrogène suivante :
2 heures2O2(aq) → 2 heures2O(1) + 1 O2(g)
Dans ce cas, un inhibiteur qui peut être utilisé est de l'acide, car lorsque le milieu est acide, la réaction se déroule plus lentement.
Mais l'inhibiteur est également largement utilisé par l'industrie, principalement pour agir comme retardateur de réaction de la dégradation naturelle des aliments, des boissons, des cosmétiques et des médicaments.
Les cosmétiques, par exemple, peuvent mettre beaucoup de temps à atteindre le consommateur; ainsi, divers conservateurs y sont utilisés, tels que le propylparaben, qui est utilisé dans la phase huileuse et agit comme antifongique, et le méthylparaben, qui est utilisé dans la phase aqueuse et qui a un effet antiseptique. Leurs structures respectives sont présentées ci-dessous :
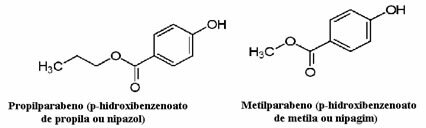
Il est intéressant de noter que sur de nombreuses étiquettes de cosmétiques, il y a la phrase suivante: « Il ne contient pas de parabènes ». Cela signifie que ce cosmétique ne contient pas ces conservateurs que nous avons mentionnés et que, normalement, ils n'ont pas été testés sur les animaux.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/inibidores-catalisador.htm

