LA nihonium, numéro atomique 113 et symbole Nh, est un élément chimique appartenant au groupe 13 du tableau périodique. De plus, c'est un élément superlourd introuvable dans la nature. Ainsi, son obtention ne peut se faire qu'artificiellement, par des réactions de fusion nucléaire. Les caractéristiques chimiques du nihonium ne sont toujours pas claires, mais on suppose qu'il se comporte de la même manière que son homologue plus léger, le thallium, dans certains cas.
Le nihonium était initialement obtenu par fusion 70Zn avec le 209Bi, au Riken Institute, Japon, en 2003. Bien que des scientifiques russes et américains aient également demandé à être reconnus comme découvreurs de l'élément 113, l'IUPAC a reconnu les scientifiques japonais. Le nom fait référence au mot Nihon, comme les Japonais appellent leur pays natal.
A lire aussi: Gallium - un autre élément chimique appartenant au groupe 13 du tableau périodique
Sujets dans cet article
- 1 - Résumé sur le nihonium
- 2 - Propriétés du nihonium
- 3 - Caractéristiques du nihonium
- 4 - Obtention du nihonium
- 5 - Histoire de Nihônio
- 6 - Exercices résolus sur le nihonium
résumé sur le nihonium
C'est un élément chimique synthétique situé dans le groupe 13 de la Tableau périodique.
Sa production a débuté en 2003, au Riken Institute, au Japon.
Il constitue le groupe d'éléments le plus récemment inclus dans le tableau périodique, en 2015.
Ses études sont encore très récentes, mais certains cherchent à le rattacher à d'autres éléments du groupe 13, comme le thallium.
Sa fabrication est La fusion nucléaire, à l'aide d'isotopes de 70Zn et atomes de 209Bi.
Ne vous arrêtez pas maintenant... Y'en a plus après la pub ;)
Propriétés du nihonium
Symbole: non
Numéro atomique: 113
Masse atomique: entre 278 et 286 cu (non officiel par Iupac)
Configuration électronique: [Rn] 7s2 5f14 6d10 7p1
Isotope le plus stable :286Nh (9,5 secondes de demi-vie, qui peut augmenter de 6,3 secondes ou diminuer de 2,7 secondes)
Série chimique : groupe 13, éléments super lourds
caractéristiques du nihonium
Nihonium, symbole Nh et numéro atomique 113, était l'un des derniers éléments inclus dans le tableau périodique. Son officialisation a eu lieu le 30 décembre 2015, par l'Union internationale de chimie pure et appliquée (UICPA), alors que son nom n'a été officialisé qu'à la mi-2016.
Les éléments de cette région du tableau périodique sont très instables, ce qui signifie qu'ils ne peuvent pas être trouvés dans la nature. Ainsi, face à une prétendue existence, ils subiraient une désintégration radioactive presque instantanément - l'émission de particules nucléaires, telles que α et β - afin d'atteindre une plus grande stabilité.
Cependant, lorsqu'ils émettent des particules nucléaires, ils finissent par subir une transmutation nucléaire, c'est-à-dire qu'ils deviennent un nouvel élément chimique. Ainsi, les éléments superlourds, comme Nh, doivent être produits en laboratoire, ce qui en fait un élément chimique synthétique.
Nh, comme les autres éléments superlourds, est influencé par effets relativistes — de manière simple, les distances de ce qui est observé à ce qui était attendu, du fait de la relativité. Ainsi, des études mathématiques dans le domaine théorique, qui simulent les conséquences de l'effet relativiste, ont souligné que le nihonium pourrait interagir faiblement avec le quartz, mais pour avoir bonne adsorption sur or, comme son homologue plus léger, le thallium (Tl).
Des études théoriques préliminaires ont également indiqué la volatilité de Nh. En ce qui concerne l'adsorption sur le quartz, le thallium forme facilement TlOH, par exemple, et le nihonium est suspecté de faire de même.
Même ainsi, comment les études sont encore très préliminaires et récentes, une grande partie de ce qui a été produit est sujette à discussion et il est difficile de déterminer avec précision les propriétés physicochimiques du nihonium.
Obtention du Nihonium
L'élément 113, jusqu'à aujourd'hui, a été obtenu de deux manières: par réactions de fusion froide, avec la fusion du zinc (Zn, Z = 30) avec le bismuth (Bi, Z = 83), et aussi par la désintégration alpha de l'élément 115.
Dans le premier exemple, le zinc est accéléré à 10 % de la vitesse de la lumière, afin de vaincre les forces répulsives des deux noyaux. Un isotope est alors produit 279Nh, qui finit par émettre un neutron et produire le 278Non.

Avec une demi-vie d'environ 34 millisecondes, l'isotope 278Nh subit six désintégrations alpha (émissions de particules alpha) vers l'élément mendélévium (Md).
Dans le second cas, l'élément 113 provient de la désintégration alpha de l'élément 115 (maintenant connu sous le nom de muscovium) après sa synthèse. Une façon est la réaction de fusion à chaud des ions 48Ca avec des isotopes 243ah, produire le 288Mc puis, par désintégration alpha, le 284Nh, qui continue de subir une désintégration alpha.
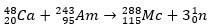
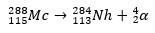
Voir aussi: Hassium - l'élément chimique synthétique le plus lourd dont les propriétés ont été analysées
histoire du nihonium
Les recherches de l'élément 113 ont commencé en 2003. Des chercheurs japonais de l'Institut Riken ont accéléré des isotopes de 70Zn à 10% de la vitesse de la lumière pour entrer en collision avec le 209Bi, par une réaction de fusion. Ainsi, ils ont réussi à produire ce que nous appelons aujourd'hui 278Non.
Cependant, ce n'est qu'en 2012 que Des chercheurs japonais ont pu détecter la série complète de désintégration alpha de l'élément 113, contactant l'IUPAC pour revendiquer la découverte.
Parallèlement aux efforts japonais, des scientifiques russes dirigés par Yuri Oganessian, en collaboration avec Des scientifiques américains, sont également venus identifier l'élément 113 grâce aux désintégrations alpha de l'élément 115. De telles expériences mettent également des scientifiques russes et américains en lice pour la reconnaissance de l'élément 113.

Cependant, l'IUPAC a trouvé que les preuves de l'institut Riken étaient plus solides et a ainsi permis aux Japonais d'avoir le droit de nommer l'élément 113. Le nom choisi était nihônio, symbole Nh, en référence au pays Japon. Le mot Japon est écrit par les Japonais en utilisant deux caractères chinois qui signifient "pays du soleil levant" et se lisent comme Nihon ou Nippon.
Le nom de nihonium a également été choisi car, en 1908, le chimiste japonais Masataka Ogawa a publié que avait découvert l'élément 43, le nommant japonais, symbole Np (qui appartient aujourd'hui au neptunium, Z = 93). Cependant, plus tard, il a été prouvé que l'élément 43 était instable, introuvable dans la nature et synthétisé seulement en 1937, recevant le nom de technétium (Tc).
Ainsi, le japonais a disparu du tableau périodique. Cependant, des années plus tard, il a été prouvé qu'en fait, Ogawa avait découvert l'élément 75 (maintenant connu sous le nom de rhénium). Cependant, à cette époque, l'élément rhénium avait déjà été officiellement découvert en 1925 et baptisé.
Exercices résolus sur le nihonium
question 1
Le nihonium, symbole Nh et numéro atomique 113, est un élément chimique introuvable dans la nature en raison de sa courte demi-vie. Le plus endurant d'entre eux, le 286Nh, a environ 9,5 secondes. Sachant que la demi-vie est le temps nécessaire pour que la quantité de l'espèce diminue de moitié, combien de secondes faut-il pour que la quantité de l'isotope ci-dessus soit 1/16 de la quantité initial?
A) 9.5
B) 19
C) 28,5
D) 38
E) 47,5
Résolution:
Variante D
Toutes les 9,5 secondes, la quantité d'isotope diminue de moitié. Ainsi, après 9,5 secondes, son montant est la moitié du montant initial. Encore 9,5 secondes, totalisant 19 secondes, le montant diminue à nouveau de moitié, atteignant 1/4 de l'initial.
À 28,5 secondes, après un autre temps de demi-vie, la quantité diminue à nouveau de moitié, atteignant 1/8 de la quantité initiale. Enfin, après 38 secondes, le montant diminue à nouveau de moitié pour atteindre 1/16 du montant initial, comme demandé dans le relevé. Ainsi, le temps nécessaire est de 38 secondes.
question 2
En 2003, la recherche de l'élément 113 a commencé à l'Institut Riken au Japon. A cette époque, les scientifiques ont pu produire le 278Nh par la fusion d'atomes de zinc et de bismuth.
Combien y a-t-il de neutrons dans l'isotope cité ?
A) 113
B) 278
C) 391
D) 170
E) 165
Résolution:
Variante E
Le nombre de neutrons peut être calculé comme suit :
A = Z + n
où A est le nombre de Pâtes atomique, Z est le numéro atomique et n est le nombre de neutrons. En substituant les valeurs, nous avons :
278 = 113 + n
n = 278 - 113
n = 165
Par Stefano Araújo Novais
Professeur de chimie
