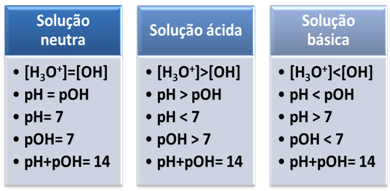
- Milieu neutre :
Un milieu est considéré comme neutre s'il a la même concentration, en mol/L, des ions hydronium (H3O+) et l'hydroxyde (OH-).
Un exemple de milieu neutre qui sert même d'étalon pour d'autres solutions est l'eau distillée pure à une température de 25 °C. A cette température, il en a exactement 1. 10-7 mol/L des deux ions. Par conséquent, votre produit ionique (Kw) est égal à 10-14 (mol/L)2:
Kw = [H3O+]. [Oh-]
Kw = (1. 10-7 mol/L). (1. 10-7 mol/L) = 10-14 (mol/L)2
Le pH et le pOH sont donnés ci-dessous :
pH= - log [H3O+] pOH= -log[OH-]
pH= - log 1. 10-7 pOH= - log 1. 10-7
pH = 7pOH = 7
Cela nous montre que, dans une solution neutre, le le pH est égal à pOH.
- Milieu acide :
En milieu acide, la concentration en ions H3O+ est plus grand que celui des ions OH-.
Une telle solution peut être obtenue en ajoutant une petite partie des ions H3O+, par exemple, au moyen d'un acide.
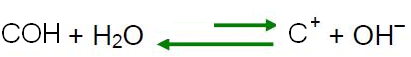
D'après le principe de Le Chatelier, lorsqu'une perturbation est causée à un système en équilibre, il tend à se réajuster afin de réduire les effets de cette force. Cela signifie que si un acide est ajouté à l'eau, les ions H
3O+ ils seront en excès et la balance se déplacera dans le sens inverse de la réaction, vers la gauche. Donc ces ions en excès vont réagir avec les ions OH-. Ainsi, la concentration des ions OH- diminuera et la solution deviendra acide.Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)

Le produit ionique (Kw) est toujours égal à 10-14, mais la concentration des ions H3O+ est supérieure à la concentration en ions OH-1. Par conséquent, le pH est supérieur au pOH en milieu acide, mais sa somme est toujours égale à 14.
De plus, plus la concentration en ions H est élevée3O+, plus la valeur du pH est élevée. A température ambiante (25°C), pH < 7 et pOH > 7.

- De base signifie :
Dans le milieu basique, la concentration en ions OH- est plus grand que celui des ions H3O+.
Si nous ajoutons une base à l'eau, cela signifie que nous ajoutons des ions OH.- et, comme expliqué dans le point précédent, par le principe de Le Chatelier, l'équilibre de la réaction de l'auto-ionisation de l'eau se déplacera dans la direction opposée, les ions en excès réagissant avec ions H3O+, diminuant votre concentration et rendant la solution basique.
Dans ce cas, le pOH sera supérieur au pH. A température ambiante (25°C), pH > 7 et pOH < 7.

Brièvement:
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Milieu neutre, acide et basique »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/meios-neutro-acido-basico.htm. Consulté le 27 juillet 2021.