À réactions d'oxydation avec des alcools secondaires sont celles dans lesquelles l'interaction entre un composé organique du groupe des alcools, qui doit être secondaire, et le réactif dit de Bayer (KMnO4) en milieu acide.
Chaque fois que le réactif de Bayer est en milieu acide (aq/H+), il subit une réaction de décomposition, produisant de l'oxyde de potassium, de l'oxyde de manganèse II et des oxygènes naissants, comme on peut le voir dans l'équation suivante :
2 kmnO4(aq/H+) → 2MnO + K2O + 5 [O]
Dans toute réaction d'oxydation, le oxygènes naissants, provenant de la décomposition du permanganate de potassium en milieu acide, attaquer les chaînes carbonées qui ont des liaisons pi entre les carbones (alcènes, alcynes et alcadiènes) ou qui sont fermés (cyclanes, cyclènes aromatiques), générant de nouveaux composés chimiques.
Dans le cas d réaction d'oxydation dans les alcools secondaires, avant de comprendre le mécanisme réactionnel, il est nécessaire de rappeler la notion d'alcool secondaire. est appelé
alcool secondaire celui dans lequel l'hydroxyle (OH) est lié à un carbone secondaire (carbone lié directement à deux autres atomes de carbone). Voir la représentation d'un alcool secondaire :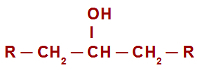
Formule développée générale d'un alcool secondaire
Dans chaque réaction d'oxydation dans les alcools, les oxygènes naissants attaquent les hydrogènes situés sur le carbone qui a le groupe hydroxyle. Dans le cas des réactions d'oxydation dans les alcools secondaires, les oxygènes n'ont qu'un seul atome d'hydrogène à attaquer dans chaque structure de ce type d'alcool.
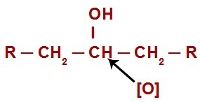
Oxygène naissant attaquant un alcool secondaire
En attaquant l'hydrogène (H) présent dans le carbone hydroxyle (OH), l'oxygène naissant ([O]) forme un nouvel hydroxyle sur le même carbone. Nous avons donc un gemino diol en prison. Comme le gemino diol (HO – C – OH) est instable, il se décompose en une molécule d'eau.Cependant, entre le carbone et l'oxygène qui reste de l'un des hydroxyles, il y a la formation d'une double liaison (pi et sigma).
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
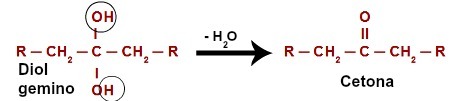
Équation chimique de l'oxydation d'un alcool secondaire
Le produit issu d'une réaction d'oxydation d'alcools secondaires est toujours un cétone, car la double liaison est toujours générée au niveau du carbone secondaire, ce qui se traduit par un carbonyle entre deux carbones, formant ainsi une cétone.
Voir maintenant un exemple de la réaction d'oxydation dans les alcools secondaires.
Exemple: Butane-2-ol
O le butan-2-ol est un alcool secondaire, puisque l'hydroxyle est attaché à un atome de carbone secondaire. Ainsi, sur le carbone qui a l'hydroxyle, il n'y a qu'un seul hydrogène. Nous pouvons vérifier ce fait dans la structure ci-dessous :

Lorsqu'il est soumis à un milieu contenant de l'eau, de l'acide et du KMnO4 (réactif de Bayer), le votre hydrogène est attaqué par un oxygène naissant, se transformant en un nouvel hydroxyle, ce qui donne un gémino diol.

Enfin, il y a une décomposition des deux hydroxyles présents dans le gemino diol, résultant ainsi en une molécule d'eau et une cétone, en raison de la nécessité de créer une liaison entre le carbone et l'un des oxygènes des hydroxyles décomposés.

nous pouvons représenter l'ensemble de la réaction d'oxydation du butane-2-ol par l'équation suivante :

Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. « Réactions d'oxydation dans les alcools secondaires »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/reacoes-oxidacao-alcoois-secundarios.htm. Consulté le 27 juillet 2021.
Chimie

Fonction hydroxyle, Alcools primaires, Alcools secondaires, Alcools tertiaires, Méthanol, Glycérol, Ethanol, préparation de nitroglycérine, fabrication de peinture, production de boissons alcoolisées, acide acétique, carburant automobiles.



