À réactions de combustion ils sont présents dans de nombreux aspects de notre vie quotidienne. Par exemple, les principales sources de production d'énergie résultent de la combustion ou de la combustion de certains combustibles, tels que l'éthanol, l'essence, le charbon de bois, entre autres. De plus, l'énergie dont nous avons besoin pour survivre et travailler est le résultat de réactions de combustion qui se produisent à l'intérieur de nos cellules lorsque nous « brûlons » les aliments que nous consommons.
Mais que faut-il pour avoir une réaction de combustion ?
Trois choses sont nécessaires :
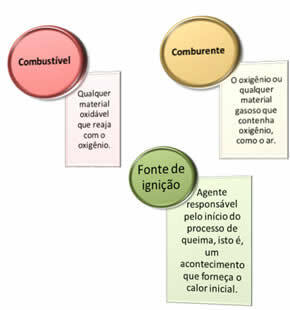
Ces trois facteurs constituent le triangle de feu, car une fois que la réaction de combustion commence, l'énergie libérée soutient la réaction et lui permet de se poursuivre jusqu'à ce que le carburant, le comburant ou la chaleur (énergie libérée) aient disparu. Cela signifie qu'il y aura un Réaction en chaîne.
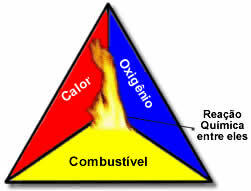
Par exemple, si quelqu'un jette une cigarette allumée dans une forêt, il y aura un incendie (réaction de combustion). Dans ce cas, le
Buisson C'est le carburant, ô l'oxygène présent dans l'air atmosphérique est le oxydant C'est le cigarette allumé était le source d'inflammation. Cette combustion continuera jusqu'à ce que l'un des trois facteurs soit éliminé. Si les pompiers jettent de l'eau, la chaleur sera éliminée. Mais même si rien n'est fait pour arrêter cette combustion, elle prendra fin à un moment donné, c'est-à-dire lorsque le combustible (la forêt) s'épuisera.Comme déjà mentionné, dans ces réactions, de la chaleur est libérée, la combustion est donc une réaction exothermique. Cependant, ce type de réaction est une combustion incomplète. Pour comprendre pourquoi, voyez la différence entre une combustion complète et incomplète :
Combustion complète :
En analysant les composés organiques comme carburants, nous devons :
| LES combustion complète cela se produira lorsque la chaîne carbonée est rompue et que tous les atomes de carbone de la chaîne carbonée sont complètement oxydés. |
| Tu produits formés par les hydrocarbures sera le CO2 (dioxyde de carbone) et H2O (L'eau). |
Observez la combustion complète de l'isooctane, qui est l'un des composants de l'essence.
Ç8H18(g) +25/2 O2 (g) → 8 CO2(g) + 9 heures2O(1)
combustion incomplète
| Dans ce cas, il n'y a pas assez de comburant, c'est-à-dire assez d'oxygène pour brûler tout le carburant. |
| Ainsi, les produits formés sont CO (monoxyde de carbone) et H2O. |
Observez cependant la même combustion de l'isoctane, maintenant incomplètement :
Ç8H18(g) + 17/2 O2(g) → 8 CO (g) + 9 heures2O(1)
Le brûlage des forêts en est un exemple, car les émissions qui en résultent sont constituées de CO et de matières particulières, telles que la suie (C), ainsi que de cendres et d'autres composés organiques simples et complexes. De l'oxyde d'azote, de l'ozone et des aldéhydes peuvent également se former à la suite de réactions secondaires dues à la présence d'autres composants dans l'air.
Ç8H18(g) + 9/2 O2 (g) → 8C (g) + 9 heures2O(1)
Par Jennifer Fogaça
Diplômé en Chimie
Équipe scolaire du Brésil
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm

