LES enthalpie est une fonction thermodynamique par laquelle calcule la chaleur impliquée dans les processus isobares, c'est-à-dire qui sont maintenus sous pression constante. Son développement a eu lieu peu de temps après la chute de la théorie calorique, avec l'avancement de thermodynamique entre les années 1840 et 1850.
L'enthalpie, pour le Quelumica, n'a pas beaucoup de sens s'il est travaillé comme une valeur absolue et isolée, mais c'est le cas lorsque l'on considère le variation de sa valeur dans un processus chimique. Il existe plusieurs façons de calculer la variation d'enthalpie d'un processus, les principales étant par les énergies de formation, de liaison et aussi par la làhé de hess.
A lire aussi: Qu'est-ce que l'énergie libre de Gibbs ?
Résumé de l'enthalpie
L'enthalpie est un outil thermodynamique pour calculer la chaleur impliquée dans les processus qui se produisent à pression constante.
Il a été défini par le physicien américain Josiah W. Gibbs, dans le contexte de la chute de la théorie calorique.
En chimie, on utilise toujours le changement d'enthalpie, représenté par ΔH.
Les réactions chimiques qui absorbent la chaleur sont dites endothermiques et ont ΔH > 0.
Les réactions chimiques qui dégagent de la chaleur sont dites exothermiques et ont ΔH < 0.
Leçon vidéo sur l'enthalpie
Qu'est-ce que l'enthalpie ?
L'enthalpie, toujours représentée par H, était initialement défini par le physicien américain Josiah Willard Gibbs, qu'il a appelé la fonction de chaleur à pression constante, puisque, selon ses termes :
« […] la diminution de fonction représente, dans tous les cas où la pression ne varie pas, la chaleur dégagée par le système.
D'après les travaux de Gibbs, nous pouvons donc comprendre l'enthalpie comme une fonction thermodynamique dont la variation est numériquement égale à la quantité de chaleur échangée dans le système, à pression constant. Cela signifie que, dans les processus isobares (comme la plupart des processus chimiques), sachant calculer la variation de la fonction enthalpie, on peut alors connaître la valeur de la chaleur échangée entre le système et quartier.

Une telle corrélation avec la chaleur provoque de nombreux étudiants pensent à tort que l'enthalpie est synonyme de Chauffer ou quelque chose comme la teneur en énergie, la teneur en chaleur, la chaleur libérée et la chaleur absorbée, etc.
L'enthalpie est apparue dans le contexte de l'effondrement de la théorie calorique, qui traitait la chaleur comme une substance matérielle impondérable qui était transférée des corps plus chauds aux corps plus froids. Ainsi, il y avait un besoin d'avoir un nouvel outil pour calculer la chaleur. La solution était donc d'utiliser des quantités qui avaient déjà défini des équations thermodynamiques, telles que l'enthalpie.
A lire aussi: Comment calculer le changement d'enthalpie de la solution?
variation d'enthalpie
Étant donné que l'enthalpie est un outil utilisé pour calculer la chaleur échangée dans un processus chimique, cela n'a aucun sens de l'utiliser comme un nombre absolu et isolé, mais compte tenu de sa variation, c'est-à-dire, en pratique, nous devrions seulement évaluer de combien, numériquement, l'enthalpie a changé au cours du processus chimique, puisque la thermodynamique nous assure que son la variation est numériquement égal à la chaleur dégagée ou absorbée dans le processus.
Strictement parlant, nous pouvons définir la variation d'enthalpie comme:
H = HFinal -Hinitiale
Comme dans les procédés chimiques, l'étape finale peut être considérée comme les produits et l'étape initiale peut être considérée comme les réactifs. Il est également courant de voir la définition de la variation d'enthalpie comme :
H = Hdes produits -Hréactifs
D'un point de vue pratique et interprétatif, si le changement d'enthalpie est positif (H> 0), on dit que la réaction chimique est endothermique, c'est-à-dire qu'il y a une absorption de chaleur tout au long du processus. Déjà si le changement d'enthalpie est négatif (H< 0), on dit que la réaction chimique est exothermique, c'est-à-dire que la chaleur est libérée tout au long du processus.
La variation d'enthalpie, dans de nombreux cas, est observée dans des graphiques, comme le montrent les exemples suivants.
Exemple 1:
Tableau de réaction endothermique
Dans les graphiques d'enthalpie pour les réactions endothermiques, on peut voir que la quantité d'enthalpie des produits est supérieure à celle des réactifs, indiquant que la variation le long de la réaction est positive. Ainsi, si ΔH > 0, on peut dire que le processus chimique s'est produit avec absorption de chaleur.
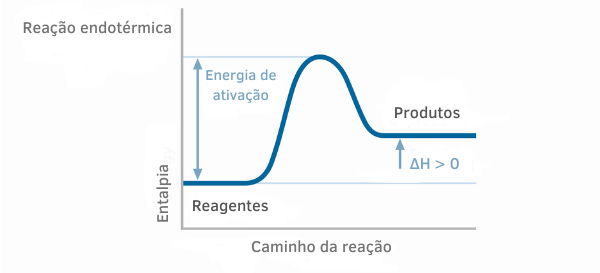
Exemple 2 :
Tableau de réaction exothermique :
Dans les graphiques d'enthalpie pour les réactions exothermiques, on peut voir que la quantité d'enthalpie des produits est inférieure à celle des réactifs, indiquant que la variation le long de la réaction est négative. Ainsi, étant H < 0, on peut dire que le processus chimique s'est produit avec dégagement de chaleur.
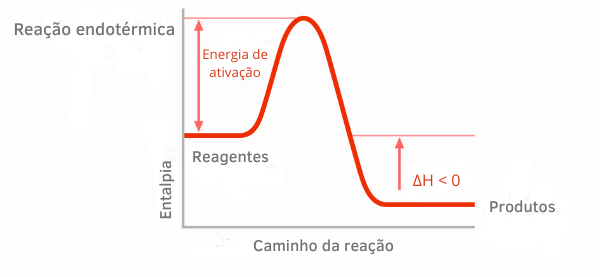
En savoir plus sur ces classifications de réactions chimiques dans le texte: POURprocessus endothermiques et exothermiques.
Types d'enthalpie
enthalpie de formation
LES enthalpie de formation é calculé basé sur formation réactions chimiques, qui sont des réactions dans lesquelles une mole de substances composées est formée à partir de leurs substances simples les plus stables à température ambiante et 1 atmosphère de pression.
H2(g) + ½ O2 (g) → H2O (l) H°F = -286 kJ/mol
Le grand avantage de l'enthalpie de formation est que les substances simples qui sont plus stables à température ambiante et 1 atmosphère de pression ont une enthalpie convenue à zéro. Cela ne veut pas dire qu'ils sont en fait nuls, mais, par souci de simplification et de meilleure classification, ils sont traités ainsi.
Étant H = Hdes produits -Hréactifs, si l'on considère alors que Hréactifs = 0, on peut dire que la valeur observée de ΔH n'est liée qu'aux produits, qui, dans ces cas, sont toujours une mole de la substance composée. Par conséquent, nous classons cette valeur comme la variation d'enthalpie standard de la formation d'eau, représentée par ΔH°F.
C'est avec cette méthodologie que plusieurs substances ont eu leurs variations de enthalpie standard tables de formation, comme nous pouvons le voir ci-dessous.
Substance |
Enthalpie de formation (ΔH°F) en kJ/mol |
CO2 (g) |
-393,4 |
CaO(s) |
-634,9 |
HI(g) |
+25,9 |
NON (g) |
+90,1 |
enthalpie de liaison
L'enthalpie de liaison sert à indiquer la quantité d'énergie impliquée dans la rupture ou la formation d'une taupe donnée. liaison chimique.
Il est bien compris que, pour rompre une liaison chimique, il faut absorber de la chaleur, de sorte que les atomes de liaison augmentent leur énergie interne et, par conséquent, augmenter votre énergie cinétique. avec plus grand énergie cinétique, les atomes vibrent plus intensément, provoquant la rupture des liaisons. Ainsi, chaque rupture de liaison est un processus endothermique.
Sinon, pour former une liaison chimique, les atomes perdent leur liberté de mouvement et doivent diminuer leur degré de mouvement, diminuant ainsi leur énergie cinétique. L'énergie de réserve est ensuite libérée sous forme de chaleur. Ainsi, toute formation de liaison est un processus exothermique.
Le tableau ci-dessous présente les valeurs des énergies associées à chaque liaison chimique.
Lien |
Énergie de liaison (kJ/mol) |
C-H |
412,9 |
C-C |
347,8 |
O═O |
497,8 |
F-F |
154,6 |
NON |
943,8 |
Notez qu'il n'y a aucun signe dans les valeurs, car elles sont en module. En effet, le signal doit être attribué par vous selon que le lien est rompu ou formé.
Enthalpie de combustion
LES enthalpie de combustion sert à indiquer le quantité de chaleur dégagée lors de la combustion d'une mole d'une substance. Il est à noter que chaque réaction de combustion est exothermique, car chaque combustion dégage de la chaleur.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2H2Le H°Ç = -889,5 kJ/mol
Le tableau ci-dessous montre les valeurs d'enthalpie de combustion pour certaines substances chimiques.
Substance |
Enthalpie de combustion (ΔH°Ç) en kJ/mol |
Éthanol - C2H5OH (1) |
-1368 |
Benzène - C6H6 (1) |
-3268 |
Octane - C8H18 (1) |
-5471 |
Glucose - C6H12O6 (s) |
-2808 |
Enthalpie de changement d'état physique
Chaque changement d'état physique implique un échange de chaleur. Par conséquent, la enthalpie de changement d'état physique sert à indiquer le quantité de chaleur impliquée dans les processus de changement d'état physique.
Par exemple, nous avons la vaporisation d'eau :
H2O (1) → H2O (g) H = +44 kJ/mol
Dans la fonte de l'eau, on a :
H2O(s) → H2O (l) H = +7,3 kJ/mol
Les valeurs d'enthalpie sont symétriques pour les processus inverses, ce qui signifie que, par exemple, la variation d'enthalpie dans la liquéfaction de l'eau est de -44 kJ/mol, alors que, dans sa solidification, elle est égale à -7,3 kJ/mol.
A lire aussi: Qu'est-ce que l'entropie ?
Exercices résolus sur l'enthalpie
Question 1 - (UERJ 2018) La capacité polluante d'un hydrocarbure utilisé comme carburant est déterminée par le rapport entre l'énergie dégagée et la quantité de CO2 formé dans sa combustion complète. Plus le ratio est élevé, plus la capacité polluante est faible. Le tableau ci-dessous montre l'enthalpie standard de combustion de quatre hydrocarbures.

D'après le tableau, l'hydrocarbure ayant la plus faible capacité polluante est :
Octane
Hexane
Benzène
pentane
Résolution
Variante D
La question indique que la capacité polluante est définie comme le rapport (quotient) entre l'énergie libérée et la quantité de CO2 formé dans sa combustion complète. Plus le raison, plus la capacité polluante est faible, c'est-à-dire plus d'énergie est libérée par mole de CO2 généré.
Les réactions de combustion complète de Hydrocarbures cités sont :
Octane: Ç8H18 +25/2 O2 → 8 CO2 + 9 heures2La raison: 5440/8 = 680
Hexane: Ç6H14 +19/2 O2 → 6 CO2 + 7 heures2La raison: 4140/6 = 690
Benzène: Ç6H6 + 15/2 O2 → 6 CO2 + 3H2La raison: 3270/6 = 545
pentane: Ç5H12 + 8O2 → 5 CO2 + 6H2La raison: 3510/5 = 702
Ainsi, on peut conclure que le pentane est l'hydrocarbure le moins polluant.
Question 2 - (Enem 2015) L'utilisation des résidus forestiers devient chaque jour plus attrayante, car il s'agit d'une source d'énergie renouvelable. La figure représente la combustion d'une bio-huile extraite de déchets de bois, où ΔH1 la variation d'enthalpie due à la combustion de 1 g de cette bio-huile, entraînant du dioxyde de carbone et de l'eau liquide, et ΔH2 le changement d'enthalpie impliqué dans la conversion de 1 g d'eau à l'état gazeux à l'état liquide.

La variation d'enthalpie, en kJ, pour brûler 5 g de cette bio-huile, résultant en CO2 (gazeux) et H2Le (gazeux) est :
A) -106
B) -94
C) -82
D) -21.2
E) -16,4
Résolution
Variante C
D'après le graphique présenté, nous avons ΔH1 comme la variation d'enthalpie de la combustion de bio-huile produisant du CO2 (g) et H2O (1) et H2 comme le changement d'enthalpie de liquéfaction de l'eau, puisque le CO2 reste gazeux et seul l'état physique du L'eau changements (de gaz à liquide).
L'exercice demande le changement d'enthalpie de la combustion de 5 g de bio-huile, résultant en CO2 (gazeux) et H2O (gazeux). A partir du diagramme, ce changement d'enthalpie peut être défini comme ΔH = ΔH1 – H2. Ainsi, la valeur de H sera égale à -16,4 kJ/g. Cette variation, comme on peut le voir dans l'unité, est pour CHAQUE gramme de bio-huile. Pour 5 grammes, il faut faire le proportion:
1 g de bio-huile -16,4 kJ
5 g de bio-huile x
1. x = 5. (-16,4)
x = -82 kJ
On peut alors marquer l'alternative C.
Par Stéfano Araújo Novais
Professeur de chimie


