Les pluies acides sont un phénomène causé par la pollution atmosphérique. Principalement à travers la combustion de combustibles fossiles dans les industries et dans les automobiles, les êtres humains ont libéré une grande quantité de gaz polluants, tels que certains oxydes.
Les oxydes sont des composés inorganiques binaires dont l'oxygène est l'élément le plus électronégatif. Parmi eux, nous avons une classe qui sont les oxydes acides, appelés ainsi car ils réagissent avec l'eau, générant des acides, et réagissent également avec des bases, formant de l'eau et du sel.
Les principaux oxydes acides rejetés dans l'atmosphère et qui réagissent avec l'eau de pluie, produisant des pluies acides, sont les oxydes de soufre (SO2 et donc3) et l'azote (N2O, NON et NON2).
Carte mentale: pluie acide

*Pour télécharger la carte mentale en PDF, Cliquez ici!
Les plus grands méchants sont les oxydes de soufre, car, comme le montrent les équations chimiques ci-dessous, ils réagissent avec de l'eau et forment de l'acide sulfurique, le même acide utilisé dans les batteries de voiture, qui est très acide. fort:
s(s) + O2(g) → SE2(g)
SEUL2(g) + H2O(1)→ ASS3(aq) (acide sulfureux)
SEUL2(g)+ ½ le2(g) → SE3(g)
SEUL3(g) + H2O(1)→ H2SEUL4(aq)(Acide sulfurique)
Les oxydes d'azote réagissent avec l'eau de pluie pour former de l'acide nitrique (HNO3) et l'acide nitreux (HNO2), ce qui, au fil du temps, peut entraîner un certain impact environnemental.
N2(g) + 2O2(g) → 2 NON2(g)
AU2(g) + H2O(1)→ HNO2(aq) + HNO3(aq)
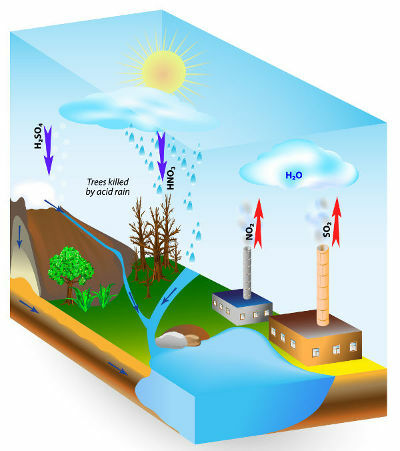
Régime de causes des pluies acides
Ce terme « pluie acide » a été utilisé pour la première fois par le chimiste et climatologue anglais Robert Angus Smith en décrivant les précipitations acides qui se sont produites sur Manchester au début de la révolution industrielle.
En effet, toute pluie est acide, car le pH de son eau est naturellement inférieur à 7, surtout autour de 5,6, compte tenu de la présence normale de dioxyde de carbone (CO2) dans l'atmosphère, qui réagit avec l'eau et génère de l'acide carbonique (H2CO3), un acide faible.
Néanmoins, techniquement on appelle « pluie acide » toute pluie qui acquiert un pH inférieur à 4,5.
L'inquiétude liée à l'occurrence des pluies acides se produit parce qu'elles causent plusieurs dommages environnementaux, amenant des problèmes pour les plantes, détruisant les feuilles et les branches des arbres, pour le sol, provoquant son altération chimique, pour les eaux des rivières et lacs, entraînant la mort des poissons, contaminant également les eaux souterraines, en plus d'être lié à l'émergence de maladies respiratoire.
En plus de ces dommages environnementaux, les pluies acides réagissent avec les carbonates, comme le marbre (calcaire – carbonate de calcium – CaCO3) qui composent les statues, les monuments historiques et de nombreux matériaux utilisés dans la construction civile, qui se sont, au fil du temps, dégradés. Ils réagissent également avec les métaux, détruisant les structures métalliques des bâtiments et des ponts.

Mur de calcaire rongé par le temps et les pluies acides
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-chuva-acida.htm

