Dans le texte "Comment fonctionnent les substances catalytiques ?», il a été démontré que les catalyseurs sont capables d'augmenter la vitesse des réactions car ils diminuent l'énergie d'activation requise pour que la réaction se produise. Ils le font en modifiant le mécanisme de réaction, en se combinant avec les réactifs et en formant un composé intermédiaire, qui à son tour devient les produits et le catalyseur.
L'un des moyens pour que cela se produise s'appelle Catalyse homogène, c'est-à-dire lorsque le catalyseur forme un système monophasique avec les réactifs.
Cela signifie que les réactifs, les produits et le catalyseur doivent tous être dans la même phase, c'est-à-dire dans le même état physique.
L'étude de ce type de catalyse est importante pour la science et l'industrie, car plusieurs réactions importantes pour la production peuvent être accélérées avec de petites quantités de catalyseurs.
Un exemple de catalyse homogène utilisé dans l'industrie est une étape intermédiaire dans la fabrication d'acide sulfurique (H
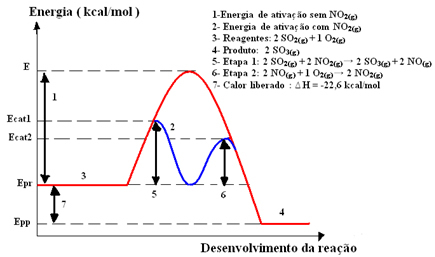
2SEUL4(aq)), dans laquelle la formation de trioxyde de soufre (SO3(g)) par réaction de combustion du dioxyde de soufre (SO2(g)), indiqué ci-dessous:2 SO2(g) + O2(g) → 2 OS3(g)
Cette réaction se déroule trop lentement, donc un catalyseur, le dioxyde d'azote (NO) est ajouté.2(g)). Ce catalyseur se combine avec le dioxyde de soufre pour former un composé intermédiaire (complexe activé), qui est le monoxyde d'azote (NO(g)).
Ce composé intermédiaire réagit alors avec l'oxygène gazeux (O2(g)) pour la régénération du catalyseur. Voyez ci-dessous comment cela se produit et observez comment ils sont tous en phase gazeuse, formant un milieu homogène :
catalyseurcomplexe activé
Étape 1: 2 OS2(g) + 2 NON2(g)→ 2 OS3(g) + 2 NON(g)
Étape 2: 2 NON(g)+ 1 O2(g) → 2 NON2 (g)
Réaction globale: 2 SO2(g) + O2(g) → 2 OS3(g)
A noter que le catalyseur ne participe qu'aux étapes intermédiaires, mais n'est pas consommé. A la fin de la réaction, il est complètement rétabli. La réaction avec ce mécanisme réalisé en deux étapes nécessite moins d'énergie d'activation et, par conséquent, elle se déroule plus rapidement.
Représentation graphique :
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/catalise-homogenea.htm


