Évaporation c'est le passage de l'état liquide à l'état gazeux. Il se produit à la surface libre des liquides, lentement et progressivement, à n'importe quelle température.
Lorsqu'une substance est à l'état liquide, elle a une force de cohésion entre ses atomes plus faible que lorsqu'elle est à l'état solide.
Dans cet état, les molécules sont plus éloignées les unes des autres, en constante agitation et se déplaçant à l'intérieur du liquide à des vitesses différentes.
De cette façon, les particules plus rapides, en atteignant la surface libre du liquide, parviennent à s'échapper, passant à l'état gazeux.

Vitesse d'évaporation
Il existe des facteurs qui influencent la vitesse à laquelle l'évaporation se produit, ce sont:
- Température: plus la température est élevée, plus la vitesse d'évaporation est rapide. Parce que plus la température est élevée, plus la énergie cinétique des particules. De cette façon, davantage de particules s'échapperont de la surface du liquide.
- Nature du liquide: il existe des substances qui s'évaporent plus facilement, on les appelle substances volatiles. L'éther, l'alcool et l'acétone sont des exemples de substances volatiles.
- surface libre: comme l'évaporation a lieu à la surface libre des liquides, plus la surface est grande, plus la quantité de particules qui sortiront du liquide est importante.
- Concentration de vapeur sur liquide: plus la quantité de vapeur est importante, plus le taux d'évaporation est faible.
- Pression exercée sur le liquide: plus la pression est élevée, plus la vitesse d'évaporation est faible.
Différence entre l'évaporation et l'ébullition
L'évaporation et ébullition représentent le passage de l'état liquide à l'état gazeux. Cependant, alors que l'évaporation se produit progressivement, l'ébullition se produit rapidement.
Pour que l'ébullition se produise, le liquide doit atteindre, pour une pression donnée, une certaine température, appelée point d'ébullition. L'évaporation peut se produire à n'importe quelle température.
Séparation des mélanges
La cristallisation fractionnée est un processus de séparation de mélanges hétérogènes. Il est utilisé lorsque les substances qui composent le mélange sont à l'état solide.
Dans ce processus, un liquide qui dissout tous les composants solides est ajouté au mélange. Les composants cristallisent ensuite séparément après évaporation de la solution.
Ce procédé est utilisé, par exemple, dans les marais salants pour obtenir des sels à partir d'eau de mer.

Évaporation et cycle de l'eau
L'évaporation est l'un des processus qui constituent le cycle de l'eau. L'énergie du soleil chauffe la surface libre des lacs, des rivières, des mers et des océans.
Ce chauffage provoque l'évaporation d'une partie de l'eau à l'état de vapeur. Celui-ci, en atteignant les plus hautes couches de l'atmosphère, se refroidit et se condense en formant des nuages.
Lors des précipitations, l'eau revient à la surface sous forme liquide, s'infiltrant dans le sol et formant des nappes souterraines.
Une partie de cette eau est absorbée par les plantes, qui renvoient la vapeur d'eau dans l'atmosphère par transpiration.
changements de phase
Le passage d'un état liquide à un état gazeux est appelé génériquement vaporisation, car il englobe, en plus de l'évaporation, deux autres processus: l'ébullition et le chauffage.
Il existe encore d'autres processus de changement d'état. Sont-ils:
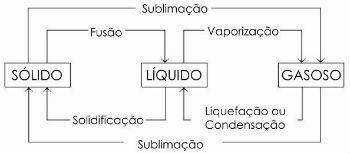
- La fusion
- Solidification
- Liquéfaction ou condensation
- Sublimation
Dans le schéma ci-dessous, nous représentons les trois états physiques de la matière et les changements d'état respectifs :
En savoir plus sur: Changements d'état physique.