Le tableau périodique est un outil d'étude important qui rassemble des informations sur tous les éléments chimiques connus.
Testez vos connaissances avec cette liste de 17 questions avec les différentes approches sur le sujet et résolvez vos doutes avec les résolutions commentées après le retour d'expérience.
Pour aider à comprendre les questions, utilisez le tableau périodique complet et mis à jour.
Organisation du tableau périodique
question 1
(UFU) Au début du XIXe siècle, avec la découverte et l'isolement de divers éléments chimiques, il est devenu nécessaire de les classer rationnellement, afin de mener des études systématiques. De nombreuses contributions ont été ajoutées jusqu'à atteindre la classification périodique actuelle des éléments chimiques. Concernant la classification périodique actuelle, répondez :
a) Comment les éléments sont-ils classés séquentiellement dans le tableau périodique ?
Le tableau périodique est organisé en séquences d'éléments chimiques dans l'ordre croissant de
numéro atomique. Ce nombre correspond au nombre de protons dans le noyau de l'atome.Ce mode d'organisation a été proposé par Henry Moseley lorsqu'il a reconfiguré le tableau proposé par Dmitri Mendeleiev.
Un élément peut être localisé dans le tableau par la famille et la période dans laquelle il est inséré. Cette répartition s'effectue de la manière suivante :
| groupes ou familles | 18 séquences verticales |
| Groupes d'éléments qui ont des caractéristiques similaires. |
| Périodes | 7 séquences horizontales |
| Nombre de couches électroniques que possède l'élément. |
b) Quels groupes dans le tableau périodique peuvent être trouvés: un halogène, un métal alcalin, un métal alcalino-terreux, un chalcogène et un gaz rare ?
La classification des éléments en groupes se fait en fonction des propriétés. Les éléments qui sont dans le même groupe ont des caractéristiques similaires et pour les classifications données nous devons :
| Classification | Grouper | Famille | Éléments |
| halogène | 17 | 7A | F, Cl, Br, I, At et Ts |
| métal alcalin | 1 | 1A | Li, Na, K, Rb, Cs et Fr |
| métal alcalino-terreux | 2 | 2A | Be, Mg, Ca, Sr, Ba et Ra |
| chalcogène | 16 | 6A | O, S, Se, Te, Po et Lv |
| gaz rare | 18 | 8A | He, Ne, Ar, Kr, Xe, Rn et Og |
question 2
(PUC-SP) Résolvez le problème en vous basant sur l'analyse des énoncés ci-dessous.
I – Le tableau périodique moderne actuel est classé par ordre croissant de masse atomique.
II - Tous les éléments qui ont 1 électron et 2 électrons dans la couche de valence sont, respectivement, les métaux alcalins et les métaux alcalino-terreux, à condition que le nombre quantique principal de cette couche (n 1).
III – Dans la même période, les éléments présentent le même nombre de niveaux (couches).
IV – Dans un même groupe (famille), les éléments ont le même nombre de niveaux (couches).
Il est conclu que, par rapport au tableau périodique actuel des éléments chimiques, ils sont corrects :
a) I et IV (uniquement).
b) I et II (uniquement).
c) II et III (uniquement).
d) II et IV (uniquement).
e) III et IV (uniquement).
Alternative correcte: c) II et III (uniquement).
En analysant chaque alternative, nous devons :
I - FAUX. Les éléments sont classés par ordre croissant de numéro atomique.
II - CORRECT. Les électrons de la couche de valence définissent le groupe dans lequel se trouve l'élément.
| métaux alcalins | 1 électron dans la couche de valence |
| 3lis | 2-1 |
| 11À | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
| métaux alcalino-terreux | 2 électrons dans la couche de valence |
| 4être | 2-2 |
| 12mg | 2-8-2 |
| 20Ici | 2-8-8-2 |
| 38m | 2-8-18-8-2 |
| 56Ba | 2-8-18-18-8-2 |
| 88La grenouille | 2-8-18-32-18-8-2 |
Le nombre quantique principal correspond à la couche dans laquelle se trouve l'électron, étant différent de 1 car par la distribution électronique nous remarquons que l'emplacement de l'électron est de la deuxième couche ou n=2.
III - CORRECT. La localisation d'un élément dans une certaine période est due au nombre de couches lors de la réalisation de la distribution électronique.
| Périodes | 7 séquences horizontales |
| 1ère période | 1 couche: K |
| 2ème période | 2 couches: K, L |
| 3ème période | 3 couches: K, L, M |
| 4ème période | 4 couches: K, L, M, N |
| 5ème période | 5 couches: K, L, M, N, O |
| 6ème période | 6 couches: K, L, M, N, O, P |
| 7ème période | 7 couches: K, L, M, N, O, P, Q |
Exemple: élément chimique situé dans la deuxième période.
IV – FAUX. Les éléments appartenant au même groupe ont des caractéristiques similaires et cela est dû au fait qu'ils ont le même nombre d'électrons dans la couche de valence.
Exemple:
| Béryllium | Magnésium |
|
2 électrons dans couche de valence. |
2 électrons dans couche de valence. |
Par conséquent, le béryllium et le magnésium font partie du groupe 2 du tableau périodique.
question 3
(Unitins) En ce qui concerne la classification périodique moderne des éléments, identifiez la véritable déclaration :
a) dans une famille, les éléments ont généralement le même nombre d'électrons dans la dernière couche.
b) sur le tableau périodique, les éléments chimiques sont placés par ordre décroissant de masses atomiques.
c) dans une famille, les éléments ont des propriétés chimiques très différentes.
d) dans une période, les éléments ont des propriétés chimiques similaires.
e) tous les éléments représentatifs appartiennent au groupe B du tableau périodique.
Alternative correcte: a) dans une famille, les éléments ont généralement le même nombre d'électrons dans la dernière couche.
a) CORRECT. Les éléments chimiques de la même famille ont le même nombre d'électrons dans la dernière couche et cela leur donne des caractéristiques similaires.
b) FAUX. Les masses atomiques augmentent à mesure que le numéro atomique de l'élément augmente.
c) FAUX. Les propriétés chimiques des éléments sont similaires, ils sont donc regroupés dans la même famille.
d) FAUX. À un moment donné, les éléments ont leurs électrons répartis dans le même nombre de coquilles.
e) FAUX. Les éléments représentatifs appartiennent au groupe A, qui correspond aux familles: 1A, 2A, 3A, 4A, 5A, 6A, 7A et 8A. Les éléments appartenant au groupe B sont des éléments de transition.
question 4
(Vunesp) Compte tenu des propriétés des éléments chimiques et du tableau périodique, il est incorrect d'affirmer :
a) un métal est une substance conductrice de courant électrique, ductile et malléable.
b) un non-métal est une substance qui ne conduit pas le courant électrique, n'est ni ductile ni malléable.
c) un semi-métal a l'apparence physique d'un métal, mais un comportement chimique similaire à celui d'un non-métal.
d) la plupart des éléments chimiques sont constitués de non-métaux.
e) les gaz rares sont monoatomiques.
Alternative incorrecte: d) la plupart des éléments chimiques sont des non-métaux.
Notez la classification des éléments chimiques sur le tableau périodique en métaux, non-métaux et semi-métaux.

Comme nous pouvons le voir, la plupart des éléments sont des métaux.
a) CORRECT. Les métaux conduisent l'électricité à cause des nuages d'électrons formés par les électrons libres, qui sont caractéristiques de leur structure. Ils sont ductiles car ils peuvent se transformer en fils ou en feuilles, selon la région où la pression est appliquée. Ils sont également malléables, car des feuilles très minces peuvent être produites avec ce type de matériau.
b) CORRECT. Les non-métaux ont les caractéristiques opposées des métaux. Au lieu de conducteurs, ce sont de bons isolants thermiques et, comme ils sont cassants, ils ne sont pas moulés en fils ou en feuilles car ils n'ont pas une bonne ductilité et malléabilité.
c) CORRECT. Les semi-métaux ont des caractéristiques intermédiaires à celles des métaux et des non-métaux. Étant des semi-conducteurs de l'électricité, ils ont un éclat métallique mais sont cassants comme les non-métaux.
d) FAUX. La plupart des éléments sont classés comme des métaux. Les classes de métaux présents dans le tableau périodique sont: alcalins, alcalino-terreux, transitionnels internes et externes.
e) CORRECT. Les gaz nobles sont monoatomiques, ils ne sont donc représentés que par leurs initiales.
Exemple:
| gaz rare | chalcogène |
| Hélium (Il) | Oxygène (O2) |
| monoatomique: formé par un atome | diatomique: formé de deux atomes |
En raison de la stabilité des gaz rares, les éléments de cette famille ont une faible réactivité et sont également appelés inertes.
question 5
À propos de l'organisation du tableau périodique actuel, répondez :
a) Que sont les colonnes ?
b) Quelles sont les lignes ?
c) Quelle est la méthode utilisée pour organiser les éléments chimiques ?
Réponses:
a) les colonnes sont les groupes du tableau périodique, anciennement appelés familles, qui rassemblent des éléments chimiques ayant des propriétés similaires.
b) Les lignes sont les périodes du tableau périodique et indiquent le nombre de couches électroniques d'un atome dans l'état fondamental.
c) Les éléments chimiques du tableau périodique actuel sont classés par ordre croissant de numéro atomique, qui indique le nombre de protons dans le noyau de l'atome.
Familles de tableaux périodiques
question 1
(CESGRANRIO) En faisant l'association entre les colonnes ci-dessous, qui correspondent aux familles d'éléments selon le tableau périodique, la séquence numérique sera :
| 1. gaz nobles | • Groupe 1A |
| 2. métaux alcalins | • Groupe 2A |
| 3. métaux alcalino-terreux | • Groupe 6A |
| 4. Chalcogènes | • Groupe 7A |
| 5. Halogènes | • Groupe 0 |
a) 1, 2, 3, 4, 5.
b) 2, 3, 4, 5, 1.
c) 3, 2, 5, 4, 1.
d) 3, 2, 4, 5, 1.
e) 5, 2, 4, 3, 1.
Alternative correcte: b) 2, 3, 4, 5, 1.
| groupes | configuration électronique |
| • Groupe 1A: 2. métaux alcalins | nous1 (avec n |
| • Groupe 2A: 3. métaux alcalino-terreux | nous2 (avec n |
| • Groupe 6A: 4. Chalcogènes | nous2np4 |
| • Groupe 7A: 5. Halogènes | nous2np5 |
| • Groupe 0: 1. gaz nobles | 1s2 (Il) ou nous2np6 (si n > 1) |
question 2
(UECE) L'élément chimique avec Z = 54 a dans sa couche de valence la configuration 5s2 5p6. Les éléments à Z = 52 et à Z = 56 appartiennent aux familles de :
a) chalcogènes et alcalino-terreux
b) halogènes et alcalis
c) halogènes et alcalino-terreux
d) chalcogènes et alcalis
Alternative correcte: a) chalcogènes et alcalino-terreux.
Compte tenu des numéros atomiques, nous avons effectué la distribution électronique et avons trouvé les résultats suivants :
| 54X et | 52Toi | 56Ba |
|
8 électrons dans couche de valence |
6 électrons dans couche de valence |
2 électrons dans couche de valence |
| Gaz nobles: famille 8A | Chalcogènes: famille 6A | Terre alcaline: famille 2A |
question 3
(F. Ibero-Americana-SP) Le groupe de tableaux périodiques qui se caractérise par la prédominance d'éléments artificiels est le suivant :
a) les lanthanides
b) les gaz rares
c) métaux de transition
d) métaux alcalino-terreux
e) actinides
Alternative correcte: e) actinides.
Les éléments artificiels sont ceux qui n'existent pas dans la nature et qui ont été synthétisés en laboratoire par des réactions nucléaires.
On les appelle aussi éléments transuraniens, car ces éléments radioactifs ont un numéro atomique supérieur à 92, ce qui correspond à l'uranium.
En général, ces éléments sont de courte durée, pouvant durer jusqu'à des fractions de seconde.
D'après ces informations, nous devons :
Les éléments présents dans la nature sont: les lanthanides, les gaz rares, les métaux de transition et les métaux alcalino-terreux. A l'exception du technétium et du prométhium, qui sont artificiels.
La prédominance des éléments artificiels sont les actinides, classés comme métaux de transition internes et insérés dans le tableau périodique sous les lanthanides. De cette série, seuls l'actinium, le thorium, le protactinium et l'uranium sont naturels.
question 4
(U. Église catholique de Salvador-BA) L'espèce X2- avec 8 électrons dans la couche la plus externe (couche de valence), il peut provenir de l'élément X, qui, dans le tableau périodique, appartient au groupe :
a) 7A
b) 6A
c) 2A
d) 1A
e) 8A
Alternative correcte: b) 6A.
Selon la règle de l'octet, pour qu'un élément acquière la stabilité, il suppose la configuration électronique d'un gaz noble, qui a 8 électrons dans la couche de valence.
Charge 2- sur l'espèce X2- indique que l'élément a gagné 2 électrons.
La configuration électronique de l'espèce ayant 8 électrons dans la couche la plus externe est ns2np6.
En perdant deux électrons, l'élément revient à son état fondamental avec une configuration électronique ns2np4.
Les 6 électrons de la couche de valence sont caractéristiques des chalcogènes, éléments de la famille 6A.
Par example:
| Élément: oxygène | configuration électronique |
| 8O | 1s22s22p4 |
| espèce O2- | 1s22s22p6 |
En savoir plus sur Familles de tableaux périodiques.
Éléments chimiques
question 1
(CESGRANRIO) Étant donné les éléments de numéros atomiques 3, 9, 11, 12, 20, 37, 38, 47, 55, 56 et 75, l'option qui ne contient que des métaux alcalins est :
a) 3, 11, 37 et 55
b) 3, 9, 37 et 55
c) 9, 11, 38 et 55
d) 12, 20, 38 et 56
e) 12, 37, 47 et 75
Alternative correcte: a) 3, 11, 37 et 55
Les métaux alcalins correspondent aux éléments chimiques qui terminent la distribution électronique avec un électron dans le sous-niveau s.
Faisant la distribution électronique des numéros atomiques donnés, nous avons les métaux alcalins suivants:
| Z = 3 | Z = 11 | Z = 37 | Z = 55 |
| Lithium | Sodium | Rubidium | Césium |
Les autres numéros atomiques correspondent aux éléments des groupes suivants :
Métaux alcalino-terreux: terminer la distribution électronique au sous-niveau s2.
| Z = 12 | Z = 38 | Z = 56 |
| Magnésium | Strontium | Baryum |
Métaux de transition: terminer la distribution électronique au sous-niveau d.
| Z = 30 | Z = 47 | Z = 75 |
| Zinc | Argent | Rhénium |
Halogènes: terminer la distribution électronique au sous-niveau p5.
| Z = 9 |
question 2
(Unirio) « Le cœur artificiel placé à Eloi a commencé à être développé il y a quatre ans aux États-Unis et est déjà utilisé par environ 500 personnes. L'ensemble, appelé Heartmate, est composé de trois pièces principales. Le plus important est un sac rond de quatre livres, de 12 centimètres de diamètre et de 3 centimètres d'épaisseur, fait de titane – un métal blanc argenté, léger et résistant. Magazine Veja, juillet 1999.
Parmi les métaux ci-dessous, celui qui possède, dans la dernière couche, un nombre d'électrons égal à celui du titane est :
a) C
poubelle
c) Ga
d) mg
EXE
Alternative correcte: d) Mg.
| Titane | configuration électronique | Répartition des couches |
| 22Toi | 1s2 2s2 2p6 3s2 3p6 4s2 3d2 | 2, 8, 10, 2 |
De la distribution électronique du titane, on voit que cet élément possède 2 électrons dans la dernière coquille.
| Élément | configuration électronique | Répartition des couches |
| 6Ç | 1s2 2s2 2p2 | 2, 4 |
| 11À | 1s2 2s2 2p6 3s1 | 2, 8, 1 |
| 31Géorgie | 1s2 2s2 2p6 3s2 3p6 4s2 3d104p1 | 2, 8, 18, 3 |
| 12mg | 1s2 2s2 2p6 3s2 | 2, 8, 2 |
| 54X et | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 | 2, 8, 18, 18, 8 |
L'élément qui a également 2 électrons dans la dernière couche est le magnésium.
question 3
(UFPA) Considérons un certain élément chimique dont le sous-niveau le plus énergétique est 5s2. Son numéro atomique et le groupe dans lequel il se situe sur le tableau périodique sont respectivement :
a) 20; 1A
b) 20; 2A
c) 38; 2A
d) 38; 1A
e) 39; 2A
Alternative correcte: c) 38; 2A
En faisant la distribution électronique, nous avons constaté que :
- L'élément chimique est situé dans la famille 2A, car il a le sous-niveau le plus énergétique le s2
- A un numéro atomique 38, qui correspond au nombre total d'électrons distribués.
- Il se situe dans la cinquième période, car la distribution électronique s'est effectuée jusqu'à la cinquième couche.
En vérifiant ces informations dans le tableau périodique, nous pouvons confirmer qu'il s'agit de l'élément strontium.
question 4
(UFC) Un atome x a un proton de plus qu'un atome y. Sur la base de ces informations, déterminez la déclaration correcte.
a) Si y est alcalino-terreux, x est un métal alcalin.
b) Si y est un gaz rare, x est un halogène.
c) Si y est un métal de transition, x est un gaz noble.
d) Si y est un gaz noble, x est un métal alcalin.
e) x est situé dans la même période avant l'atome y dans le tableau périodique.
Alternative correcte: d) Si y est un gaz noble, x est un métal alcalin.
Le tableau périodique est classé par ordre croissant de numéro atomique.
Si Y a le numéro atomique z et que X a un proton de plus que lui, cela signifie que ces deux éléments sont dans la même période et X est postérieur à Y.
Exemple:
| Élément | élément suivant |
| zOui | z + 1X |
| 11À | 12mg |
Les deux éléments sont dans la 3ème période et le magnésium a un proton de plus que le sodium.
Selon ce raisonnement, nous devons :
Un tort. Un métal alcalin précède un métal alcalino-terreux dans le tableau périodique. L'énoncé correct serait: Si y est un métal alcalin, x est un alcalino-terreux.
b) FAUX. Un halogène précède le gaz rare dans le tableau périodique. L'énoncé correct serait: Si y est un halogène, x est un gaz noble.
c) FAUX. Les métaux de transition et les gaz rares sont séparés par d'autres éléments chimiques et ne sont donc pas séquentiels.
d) CORRECT. Les gaz nobles sont le dernier groupe du tableau périodique et les métaux alcalins le premier, ils sont donc séquentiels.
Exemple:
| gaz rare | métal alcalin |
| zOui | z + 1X |
| 2il | 3lis |
Le lithium, un métal alcalin, a un proton de plus que l'hélium, qui est un gaz noble.
e) FAUX. X est dans la même période que Y mais après, pas plus tôt que les états alternatifs.
question 5
A partir du numéro atomique d'un élément chimique, il est possible de connaître :
a) le nombre de neutrons dans le noyau
b) le nombre d'électrons dans l'électrosphère
c) la masse du noyau
Réponse: b) le nombre d'électrons dans l'électrosphère
Un atome à l'état fondamental est électriquement neutre. Ainsi, connaissant le numéro atomique, qui correspond au nombre de protons (particules chargées positivement), on connaît le nombre d'électrons (particules chargées négativement) dans l'électrosphère.
Par exemple, le fer a un numéro atomique 26, donc à l'état fondamental, il a 26 électrons autour du noyau.
En savoir plus sur éléments chimiques C'est le numéro atomique.
Propriétés périodiques et apériodiques
question 1
(UFSM) Jugez si les affirmations relatives aux propriétés périodiques des éléments sont vraies (T) ou fausses (F).
( ) Dépend des masses atomiques des éléments.
( ) Elles se répètent à intervalles plus ou moins réguliers en fonction de l'augmentation des numéros atomiques.
( ) Sont similaires dans le même groupe d'éléments.
( ) Sont similaires dans la même période d'éléments.
( ) Dans le même groupe, les valeurs numériques des propriétés périodiques augmentent toujours lorsqu'il y a une augmentation du nombre atomique des éléments.
La séquence correcte est :
a) V - F - V - F - F
b) V - F - F - V - V
c) F - V - V - F - F
d) F - V - F - V - V
e) V - F - F - V - F
Alternative correcte: c) F - V - V - F - F
(FAUX) Dépendent des masses atomiques des éléments.
Selon la loi de périodicité de Moseley, de nombreuses propriétés physiques et chimiques des éléments chimiques varient selon le numéro atomique.
(VRAI) Ils se répètent à intervalles plus ou moins réguliers en fonction de l'augmentation des numéros atomiques.
Des propriétés telles que le rayon atomique, le volume atomique, la densité, le point de fusion et l'ébullition sont des exemples de propriétés qui se reproduisent régulièrement dans le tableau périodique.
(VRAI) Sont similaires dans le même groupe d'éléments.
Les groupes du tableau périodique ont été organisés avec des éléments qui ont des propriétés similaires.
(FAUX) Sont similaires dans la même période d'éléments.
Les propriétés sont similaires dans les familles, pas dans les périodes. Dans les périodes, les éléments sont répartis par le nombre de couches électroniques.
(FAUX) Dans le même groupe, les valeurs numériques des propriétés périodiques augmentent toujours lorsqu'il y a une augmentation du nombre atomique des éléments.
Les propriétés peuvent augmenter ou diminuer en fonction du numéro atomique. Un exemple de ceci est l'électronégativité, qui diminue à mesure que le numéro atomique augmente dans un groupe donné.
A lire aussi: Propriétés périodiques
question 2
(FAESP) Les propriétés apériodiques des éléments sont :
a) densité, volume atomique et masse atomique.
b) point de fusion, électronégativité et chaleur spécifique.
c) volume atomique, masse atomique et point de fusion.
d) masse atomique, chaleur spécifique et point de fusion.
e) masse atomique et chaleur spécifique.
Alternative correcte: e) masse atomique et chaleur spécifique.
Les propriétés apériodiques sont répétées à intervalles réguliers.
La masse atomique est la mesure du poids de l'atome en unités de masse atomique, ce qui correspond à de la masse du carbone 12.
La chaleur spécifique détermine la quantité de chaleur nécessaire pour augmenter la température de 1 °C de 1 g de l'élément.
Ces deux propriétés ne sont pas liées à la position de l'élément sur le tableau périodique.
Les autres propriétés sont classées comme périodiques car elles augmentent ou diminuent avec le numéro atomique. Sont-ils:
- Densité: représente le quotient entre la masse et le volume d'un élément.
- Volume atomique: représente le volume d'un ensemble d'atomes et influence la distance entre eux.
- Point de fusion: température à laquelle se produit le passage du solide au liquide.
- Electronégativité: capacité de l'atome à attirer à lui la paire électronique qu'il partage dans une liaison covalente.
A lire aussi: électronégativité et Affinité électronique
question 3
(PUC-PR) Parmi les schémas suivants liés au tableau périodique, lesquels sont corrects ?
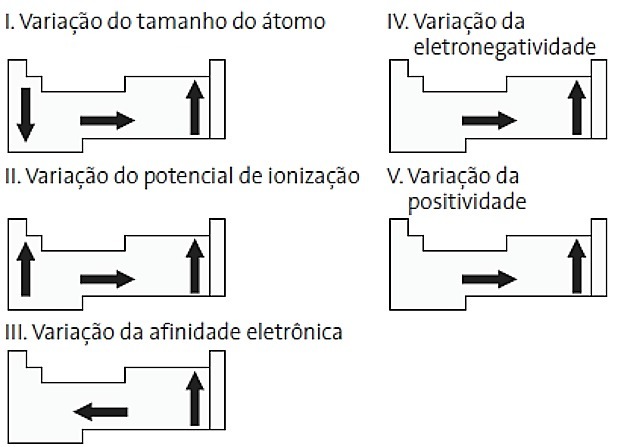
a) II et V
b) II et III
c) I et V
d) II et IV
e) III et IV
Alternative correcte: d) II et IV.
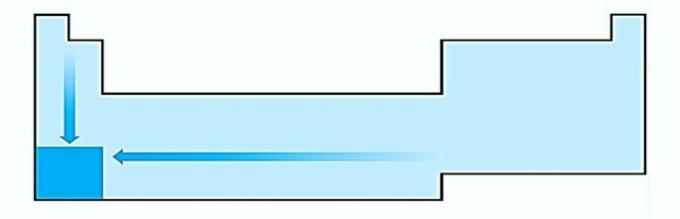
JE. TORT. La variation de la taille des atomes est mesurée par la distance moyenne entre le noyau et l'électron le plus externe. Les plus gros atomes sont situés au bas du tableau, donc l'augmentation se produit en fonction du numéro atomique et la représentation correcte est :
II. CORRIGER L'énergie nécessaire pour arracher un électron à un atome isolé à l'état gazeux s'appelle le potentiel d'ionisation. Il augmente comme indiqué dans le diagramme d'instructions.
III. TORT. L'affinité électronique exprime l'énergie libérée lorsqu'un atome neutre à l'état gazeux reçoit un électron, ce qui est une propriété très importante des non-métaux. Les affinités électroniques les plus élevées sont observées dans les halogènes et l'oxygène.
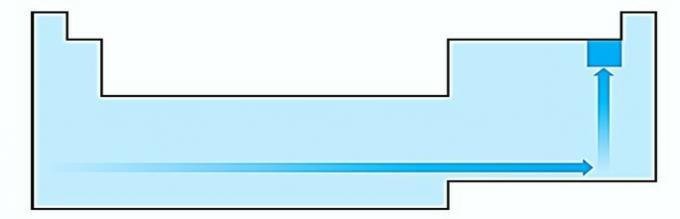
IV. CORRIGER L'électronégativité est liée au potentiel d'ionisation et à l'affinité électronique. En tant que tels, les halogènes sont les éléments les plus électronégatifs du tableau périodique.
V. TORT. L'électropositivité se produit dans la direction opposée à l'électronégativité. Il représente la capacité de l'atome à céder des électrons.
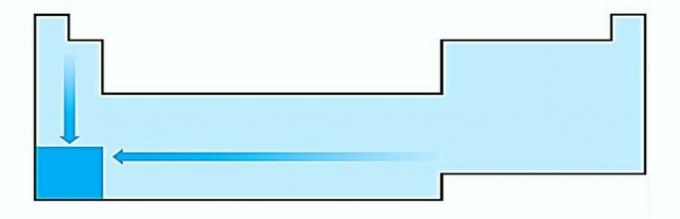
Par conséquent, les métaux alcalins ont l'électropositivité la plus élevée.
Continuez à tester vos connaissances avec les listes :
- Exercices sur les liaisons chimiques
- Exercices sur la distribution électronique
- Exercices sur les modèles atomiques
- Exercices sur la thermochimie