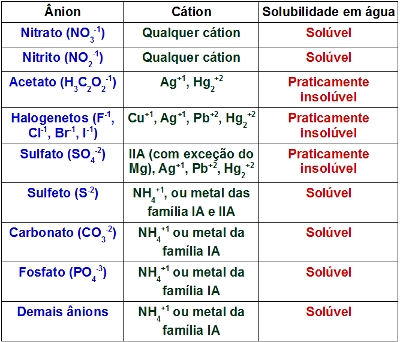
Une substance pure est formée d'un seul type d'espèce chimique, c'est-à-dire que sa composition et ses propriétés sont fixes. Un mélange contient plus d'un type de composant, donc son organisation varie.
Ainsi, nous ne pouvons distinguer une substance pure d'un mélange que lorsque nous connaissons sa composition.
En comparant un verre d'eau et un verre de sucre dissous, nos yeux ne remarquent aucune différence. Cependant, si nous ingérons le contenu des deux verres, nous remarquerons que l'un est la substance pure et l'autre est constitué d'un mélange.
substances pures
Une substance pure est l'ensemble d'une seule espèce chimique, c'est-à-dire qu'elle n'est pas mélangée avec d'autres.
Prenons l'eau comme exemple. L'eau (H2O) est reconnu pour ses caractéristiques et les propriétés spécifiques de ce matériau nous aident à l'identifier. Le principal propriétés de l'eau elles sont:
| Densité | 1,00 g/cm3 |
|---|---|
| Point de fusion | 0°C |
| Point d'ébullition | 100°C |
Lorsqu'un matériau a des propriétés fixes et invariables dans son ensemble, on dit que c'est un substance pure.
Lorsque nous mettons du sel de table, du chlorure de sodium (NaCl), dans un verre d'eau et remuons, un changement se produira.

Le résultat est un produit avec une densité intermédiaire entre celle de l'eau et du sel. C'est parce que l'eau n'est plus une substance pure et est devenue un Mélanger.
En essayant de congeler ce mélange, vous remarquerez que la température de fusion sera inférieure à 0 °C et que de plus ce mélange ne bouillira pas à 100 °C, il faudra plus de chaleur pour évaporer ce produit.
Substances pures simples et composées
Les substances pures sont classées comme simples lorsque dans leur composition il y a des atomes d'un seul élément chimique.
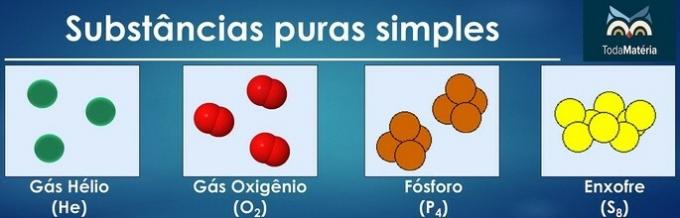
L'arrangement des atomes de deux ou plusieurs éléments chimiques forme des substances composites pures.

Mélanges
Un mélange correspond à la réunion de deux ou plusieurs substances pures, appelées composants.
Contrairement aux substances pures, ses propriétés ne sont pas fixes car elles dépendent de la proportion de composants dans le mélange.
Voyez comment la densité, une propriété physique, varie avec la quantité de sel mélangée à l'eau.
| Pourcentage de sel dans masse totale du mélange |
Densité du mélange (g/cm3) à 20 °C |
|---|---|
| 1 | 1,005 |
| 8 | 1,056 |
| 12 | 1,086 |
| 16 | 1,116 |
| 26 | 1,197 |
Source: FURNISS, B. S. et al. Manuel de Vogel's de chimie organique pratique. 4. éd. Londres: Longman, 1987. P. 1.312.
Par conséquent, l'ajout d'eau et de sel, en toute proportion, a une densité variable et, par conséquent, nous ne pouvons pas classer le mélange comme eau ou sel.
Mélanges homogènes et hétérogènes
Les mélanges homogènes sont ceux qui présentent les composants en une seule phase et, par conséquent, les mêmes propriétés en tout point.

Lorsque nous percevons visuellement plus d'une phase, le mélange est alors classé comme hétérogène.

Résumé sur les substances pures et les mélanges
| Substances pures et mélanges | |
|---|---|
|
système homogène (une seule phase) |
substance pure (un composant) |
|
mixture homogène (plus d'un composant dans la même phase) | |
|
système hétérogène (plus d'une phase) |
substance pure (un composant dans différents états physiques) |
|
une mixture hétérogène (plus d'un composant dans plus d'une phase) |
Pour en savoir plus, n'oubliez pas de consulter ces textes:
- Atomes
- Éléments chimiques
- Séparation des mélanges
Exercices avec retours commentés
1. (UFMG) Un échantillon d'une substance pure X avait certaines de ses propriétés déterminées. Toutes les alternatives ont des propriétés utiles pour identifier cette substance, sauf :
a) densité.
b) la masse de l'échantillon.
c) solubilité dans l'eau.
d) température d'ébullition.
e) température de fusion.
Mauvaise alternative: b) masse de l'échantillon.
a) CORRECT. La densité est la quantité de matière dans un volume donné. En tant que propriété spécifique à un matériau, il est utile pour identifier une substance.
b) FAUX. La masse est la quantité de matière dans un corps. Cette propriété s'appliquant à toute matière, quelle que soit sa constitution, il n'est pas possible de l'utiliser pour identifier une substance.
c) CORRECT. La solubilité est la capacité d'une substance à se dissoudre ou non dans un liquide donné. En tant que propriété spécifique à un matériau, il est utile pour identifier une substance.
d) CORRECT. La température d'ébullition correspond à la température de passage de l'état liquide à l'état gazeux. En tant que propriété spécifique à un matériau, il est utile pour identifier une substance.
e) CORRECT. La température de fusion correspond à la température de passage de l'état liquide à l'état solide. En tant que propriété spécifique à un matériau, il est utile pour identifier une substance.
2. (Vunesp) L'étiquette d'une bouteille d'eau minérale est reproduite ci-dessous.
| Composition chimique probable : |
|---|
| Sulfate de calcium 0,0038 mg/L |
| Bicarbonate de calcium 0,0167 mg/L |
Sur la base de ces informations, nous pouvons classer l'eau minérale comme:
a) substance pure.
b) substance simple.
c) mélange hétérogène.
d) mélange homogène.
e) suspension colloïdale.
Alternative correcte: d) mélange homogène.
Un tort. L'eau serait pure si sa composition n'avait que des molécules H2O.
b) FAUX. Une substance simple est constituée d'atomes d'un seul élément chimique. L'eau pure n'est pas non plus une substance simple, car elle est formée d'atomes d'hydrogène et d'oxygène (H2O) il est classé comme composite.
c) FAUX. Un mélange hétérogène a plus d'une phase, auquel cas on ne peut observer que de l'eau.
d) CORRECT. Comme il n'a qu'une seule phase, le système est homogène. En regardant la bouteille d'eau, on ne peut voir que le liquide, car les composés de sulfate de calcium et de bicarbonate de calcium sont solubles dans l'eau et sont donc dissous.
e) FAUX. Une suspension colloïdale est un mélange hétérogène dont les composants sont différenciés à l'aide d'un microscope.
3. (UCDB) Dans un laboratoire de Chimie, les mélanges suivants ont été préparés :
JE. eau/essence
II. eau/sel
III. eau/sable
IV. essence/sel
V. essence/sable
Lequel de ces mélanges est homogène ?
a) Aucun.
b) Seulement II.
c) II et III.
d) I et II.
e) II et IV.
Alternative correcte: b) Seulement II.
Un tort. L'eau est un composé inorganique et l'essence un composé organique. Ces substances n'ont pas la capacité d'interagir et du fait qu'elles ont des densités différentes, elles forment un mélange hétérogène.
b) CORRECT. Le sel, le chlorure de sodium, se dissout dans l'eau en formant une solution, qui est un mélange homogène.
c) FAUX. Le sable, le dioxyde de silicium, forme un mélange hétérogène avec l'eau.
d) FAUX. Le sel est un composé inorganique et l'essence un composé organique. Ces substances n'ont pas la capacité d'interagir et du fait qu'elles ont des densités différentes, elles forment un mélange hétérogène.
e) FAUX. Le sable est un composé inorganique et l'essence un composé organique. Ces substances n'ont pas la capacité d'interagir et forment donc un mélange hétérogène.
4. (Ufes) Dans un système bien mélangé composé de sable, sel, sucre, eau et essence, le nombre de phases est :
a) 2.
b) 3.
c) 4.
d) 5.
e) 6.
Alternative correcte: b) 3.
PHASE 1: Le sel et le sucre sont capables d'interagir avec l'eau et par des forces intermoléculaires, les molécules se lient et forment une solution, qui est un mélange homogène.
PHASE 2: L'eau est un composé inorganique et l'essence un composé organique. Ces substances n'ont pas la capacité d'interagir et du fait qu'elles ont des densités différentes, elles forment un mélange hétérogène.
PHASE 3: Le sable est un silicate qui n'a aucune affinité chimique avec l'eau et l'essence et représente donc une phase.
5. (Mackenzie) Le mélange formé par :
a) glaçons et solution aqueuse de sucre (glucose).
b) N gaz2 et Cie2.
c) eau et acétone.
d) eau et sirop de groseille.
e) le kérosène et le gasoil.
Alternative correcte: a) glaçons et solution aqueuse de sucre (glucose).
a) CORRECT. Il est possible d'observer deux phases: les glaçons et la solution de glucose, c'est donc un système hétérogène.
b) FAUX. Les gaz sont toujours un mélange homogène.
c) FAUX. Des liaisons hydrogène se forment entre le carbonyle de la propanone et la molécule d'eau. S'agissant de substances polaires, l'acétone est capable de se solubiliser dans l'eau et de former un mélange homogène.
d) FAUX. Ces deux composants se mélangent pour former un système homogène, car nous ne verrons qu'un liquide rouge du sirop de groseille, car une dilution se produit en ajoutant de l'eau.
e) FAUX. Les deux sont des composés organiques et en raison de leur affinité chimique, ils forment une seule phase, représentant un système homogène.
Testez vos connaissances avec les exercices :
- Exercices sur mélanges homogènes et hétérogènes
- Exercices sur la séparation des mélanges
- Exercices sur les propriétés de la matière