
Parfois, cela peut arriver à formule minimale être la même que la formule moléculaire du composé; Cependant, ce n'est pas toujours vrai.
Par exemple, la formule empirique ou minimale pour l'eau est H2O, indiquant qu'il existe un rapport de 2:1 entre les éléments qui composent les molécules d'eau. Et, par coïncidence, c'est aussi la formule moléculaire de l'eau. Cependant, pour voir que cela ne se produit pas toujours, regardez les deux exemples suivants :
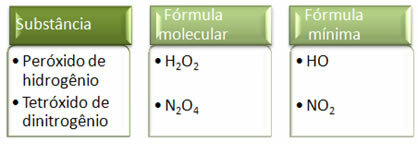
Étant donné que la formule minimale n'est que le rapport des atomes de chaque élément et non leur quantité réelle dans la formule moléculaire, cela peut se produire de différents composés ayant la même formule empirique et même la formule minimale d'un composé peut être la même que la formule moléculaire de autre. Notez, dans l'exemple ci-dessous, comment cela peut se produire :
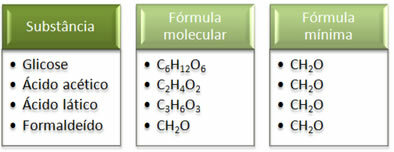
Voir que la formule minimale CH2Le est le même pour toutes les substances, c'est-à-dire que cette formule minimale exprime que, dans tous les cas, le les atomes de carbone, d'hydrogène et d'oxygène sont présents dans les formules moléculaires dans un rapport de 1:2:1. De plus, le seul qui a la même formule moléculaire que la formule empirique est le formaldéhyde.
- Calcul de la formule minimale ou empirique :
Pour déterminer la formule empirique d'un composé, il faut d'abord connaître son pourcentage ou sa formule approximative. Cela peut être fait en mesurant la masse de chaque élément dans 100g d'un échantillon. Le texte "Pourcentage ou formule centésimale” clarifie mieux cette affaire.
Par exemple, disons que la composition approximative d'un composé donné est donnée par: 40,00 % C, 6,67 % H et 53,33 % O. On passe ces valeurs en grammes, en considérant une masse de 100 g d'échantillon de compost. Ainsi, nous avons: 40 g de C, 6,67 g de H et 53,33 g de O.
Il faut maintenant passer ces valeurs à la quantité de matière (mol). Nous le faisons en divisant chacune des valeurs trouvées par leurs masses molaires respectives :
C: 40/12 = 3,33
H: 6,67/1 = 6,67
O: 53,33/16 = 3,33
Puisque les valeurs ne sont pas des entiers, nous utilisons le dispositif suivant: nous divisons toutes les valeurs par la plus petite d'entre elles, de sorte que la proportion entre elles ne soit pas modifiée.
Dans ce cas, la plus petite valeur est 3,33, donc le résultat sera :
C: 3,33/3,33 = 1
H: 6,67/3,33 = 2
O: 3,33/3,33 = 1
Ainsi, la formule minimale de cette substance inconnue est égale à: Ç1H2O1 ou alors CH2O.
En bref, les étapes nécessaires pour trouver la formule empirique ou minimale d'une substance sont :

Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm



