À réactions d'hydratation dans alcadiènes elles sont réactions d'addition, c'est-à-dire que les composants (hydronium et hydroxyde) de la molécule d'eau sont ajoutés à un alcadiène.
Toi alcadiènes sont des hydrocarbures qui ont une chaîne ouverte et deux doubles liaisons (formées par un sigma et un pi) entre les carbones, comme on peut le voir dans la structure suivante :

Formule développée d'un alcadiène
pour le réaction d'hydratation dans les alcadiènes est effectuée, il est essentiel que la liaison pi, présente dans la double liaison, soit rompue par l'influence de la chaleur et de l'acide sulfurique (H2SEUL4). Avec la rupture de la liaison pi, deux sites de liaison apparaissent, chacun sur l'un des carbones impliqués dans la double liaison.

Émergence de sites de liaison avec perturbation de la liaison pi
L'apparition de sites de liaison sur la molécule d'alcadiène est nécessaire pour les ions (H+ et oh-) de l'eau sont ajoutés à l'alcadiène, formant, par exemple, un dialcool (de l'alcool avec deux hydroxyles).
Ajout de H+ et oh- dans la structure d'un alcadiène
REMARQUE: L'ajout du H+ et oh- dans la structure alcadiène suit le La règle de Markovnikov, c'est-à-dire le H+ se lie au carbone le plus hydrogéné, et le OH- se lie au carbone moins hydrogéné.

Exemple d'application de la règle de Markovnikov dans l'hydratation des alcadiènes
Comme il existe différents types d'alcadiènes en ce qui concerne la position des doubles liaisons, il se peut que l'hydratation d'un alcadiène forme des composés différents. Voir les cas suivants :
→ Alcadiène accumulé ou condensé
C'est un alcadiène qui a deux doubles liaisons impliquant simultanément trois atomes de carbone, c'est-à-dire qu'il n'y a pas de liaison simple séparant les carbones impliqués dans les liaisons double.

Formule développée d'un alcadiène accumulé
Au cours de la réaction d'hydratation d'un alcadiène alternatif, les liaisons pi sont rompues, étant le H+ ajouté aux carbones plus hydrogénés et à l'OH- ajouté aux charbons moins hydrogénés :
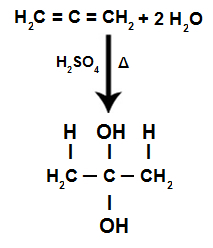
Équation de la réaction d'hydratation des alcadiènes accumulés
Nous avons que dans l'hydratation d'un alcadiène accumulé, le même atome de carbone reçoit les deux hydroxyles, formant un alcool jumeau, qui est une structure instable.

Structure de l'alcool formé de jumeaux
Comme l'alcool jumeau est instable, nous avons la formation d'une molécule d'eau avec les composants des deux hydroxyles et la création d'une liaison pi entre le carbone et l'oxygène.

Formation d'une cétone à partir d'un alcool jumeau
Par conséquent, la réaction d'hydratation des alcadiènes accumulés entraînera la formation d'un cétone.
→ Alcadiène conjugué ou alternatif
C'est un alcadiène qui a deux doubles liaisons impliquant simultanément quatre atomes de carbone, c'est-à-dire qu'il existe une seule liaison séparant les carbones impliqués dans les liaisons double.
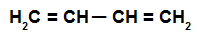
Formule développée d'un alcadiène alternatif
Dans les alcadiènes alternés, la résonance de leurs doubles liaisons se produit. Ainsi, les électrons de la liaison pi changent de position (flèches rouges), comme dans le schéma suivant :
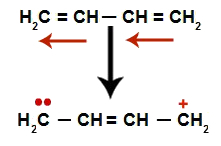
Schéma illustrant la résonance dans un alcadiène alternatif
Nous avons, en général, l'apparition d'une double liaison exactement entre les carbones où les deux doubles étaient auparavant et la création de deux sites de liaison, un sur chaque carbone qui ne fait plus la double liaison (dans l'exemple, les carbones 1 et 4). Les carbones 1 et 4 de la chaîne reçoivent le H+ et le oh- de l'eau.

Hydratation partielle en alcadiène alterné
Après résonance, la liaison pi de la nouvelle double liaison est rompue, et un H+ et un oh- sont ajoutés à la molécule d'alcadiène. L'OH est ajouté au carbone le plus proche du premier groupe OH ajouté car il subit l'attraction électronique du groupe, qui est plus électronégatif.

Fin de l'hydratation dans un alcadiène alterné
En raison de la résonance, on dit que l'alcadiène alternatif a subi une hydratation de 1,4, formant un dialcool.
→ Isolation alcadiène
C'est un alcadiène qui possède deux doubles liaisons impliquant au moins cinq atomes simultanément. de carbone, c'est-à-dire qu'il y a au moins deux liaisons simples séparant les carbones impliqués dans les liaisons double.

Formule développée d'un alcadiène isolé
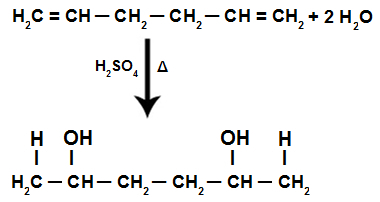
Au cours de la réaction d'hydratation d'un alcadiène isolé, les liaisons pi sont rompues, le H+ ajouté aux carbones plus hydrogénés et à l'OH- ajoutés aux charbons les moins hydrogénés.

Équation de réaction d'hydratation d'alcadiène isolé
Par conséquent, dans l'ajout d'un alcadiène isolé, nous n'avons que la formation d'un dialcool.
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/reacoes-hidratacao-alcadienos.htm
