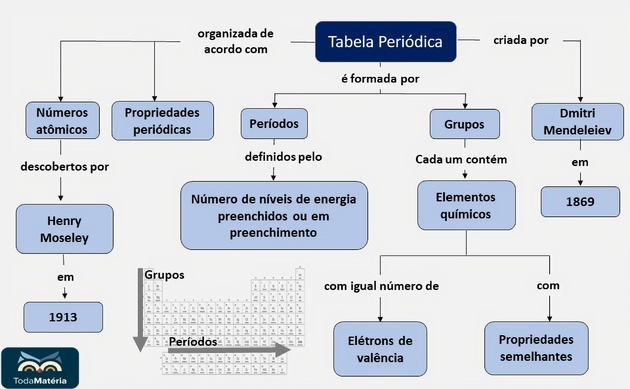
LES Tableau périodique est un modèle qui regroupe tous les éléments chimiques connus et leurs propriétés. Ils sont classés par ordre croissant de numéros atomiques (nombre de protons).
Au total, le nouveau tableau périodique a 118 éléments chimiques (92 naturels et 26 artificiels).
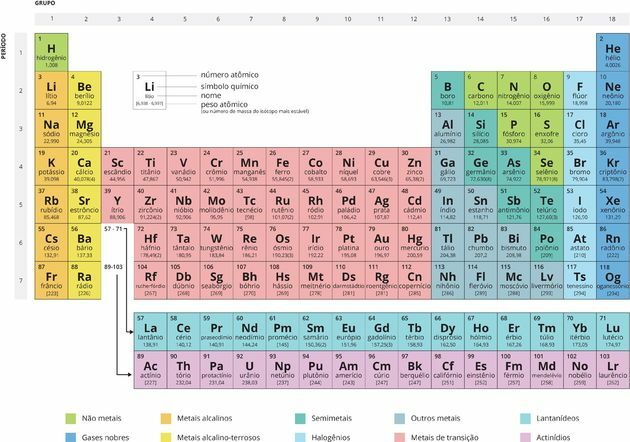
Chaque carré précise le nom de l'élément chimique, son symbole et son numéro atomique.
Organisation du tableau périodique
les appels Périodes ce sont des lignes horizontales numérotées, qui ont des éléments qui ont le même nombre de couches électroniques, totalisant sept périodes.
- 1ère période: 2 éléments
- 2ème période: 8 éléments
- 3ème période: 8 éléments
- 4e période: 18 éléments
- 5e période: 18 éléments
- 6e période: 32 éléments
- 7e période: 32 éléments
Avec l'organisation des périodes dans le tableau, certaines lignes horizontales deviendraient très longues, il est donc courant de représenter la série des lanthanides et la série des actinides à part les autres.
À Familles ou alors groupes sont les colonnes verticales, où les éléments ont le même nombre d'électrons dans la couche la plus externe, c'est-à-dire dans le
couche de valence. De nombreux éléments de ces groupes sont liés selon leur propriétés chimiques.Il existe dix-huit Groupes (A et B), et les familles les plus connues appartiennent au Groupe A, également appelé éléments représentatifs:
- 1Une famille: Métaux alcalins (lithium, sodium, potassium, rubidium, césium et francium).
- 2Une famille: Métaux alcalino-terreux (béryllium, magnésium, calcium, strontium, baryum et radium).
- Famille 3A: Famille du bore (bore, aluminium, gallium, indium, thallium et nihonium).
- Famille 4A: Famille du carbone (carbone, silicium, germanium, étain, plomb et flérovium).
- 5Une famille: Famille de l'azote (azote, phosphore, arsenic, antimoine, bismuth et muscovy).
- 6A Famille: Chalcogènes (oxygène, soufre, sélénium, tellure, polonium, foie).
- Famille 7A: Halogènes (fluor, chlore, brome, iode, astate et ténessine).
- Famille 8A: Gaz nobles (Hélium, Néon, Argon, Krypton, Xénon, Radon et Oganessonium).
Toi éléments de transition, aussi appelés métaux de transition, représentent les 8 familles du groupe B :
- Famille 1B: cuivre, argent, or et roentgen.
- Famille 2B: zinc, cadmium, mercure et copernic.
- Famille 3B: séries scandium, yttrium et lanthanide (15 éléments) et actinides (15 éléments).
- Famille 4B: titane, zirconium, hafnium et rutherfordium.
- Famille 5B: vanadium, niobium, tantale et dubnium.
- Famille 6B: chrome, molybdène, tungstène et seaborgium.
- Famille 7B: manganèse, technétium, rhénium et bohrium.
- Famille 8B: fer, ruthénium, osmium, hassium, cobalt, rhodium, iridium, meitnerium, nickel, palladium, platine, darmstadium.
Par détermination de l'Union internationale de chimie pure et appliquée (IUPAC), les groupes ont commencé à être organisés par numéros de 1 à 18, bien qu'il soit encore courant de trouver des familles décrites par des lettres et des chiffres comme indiqué ci-dessus.
Une différence importante générée par le nouveau système présenté par l'IUPAC est que la famille 8B correspond aux groupes 8, 9 et 10 du tableau périodique.
Tableau périodique noir et blanc
Histoire du tableau périodique
Le but fondamental de la création d'un tableau était de faciliter la classification, l'organisation et le regroupement des éléments en fonction de leurs propriétés.
Avant d'atteindre le modèle actuel, de nombreux scientifiques ont créé des tableaux qui pourraient démontrer un moyen d'organiser les éléments chimiques.
Le tableau périodique le plus complet a été établi par le chimiste russe Dmitri Mendeleïev (1834-1907), en 1869 en raison de la masse atomique des éléments.
Mendeleev a organisé des groupes d'éléments selon des propriétés similaires et a laissé des espaces vides pour les éléments qu'il croyait encore être découverts.
Le tableau périodique tel que nous le connaissons aujourd'hui a été organisé par Henri Mosley, en 1913, par ordre de numéro atomique éléments chimiques, réorganisant le tableau proposé par Mendeleev.
Guillaume Ramsay découvert les éléments néon, argon, krypton et xénon. Ces éléments, avec l'hélium et le radon, faisaient partie de la famille des gaz rares dans le tableau périodique.
Glenn Seaborg découvre les éléments transuraniens (numéros 94 à 102) et propose en 1944 la reconfiguration du tableau périodique, plaçant la série des actinides en dessous de la série des lanthanides.
En 2019, le tableau périodique fête ses 150 ans et une résolution des Nations Unies et de l'UNESCO a été créée pour en faire l'Année Tableau périodique international des éléments chimiques comme moyen de reconnaître l'une des créations les plus influentes et les plus importantes de la science.
Curiosités du tableau périodique
- L'Union Internationale de Chimie Pure et Appliquée Union internationale de chimie pure et appliquée - IUPAC) est une ONG (Organisation Non Gouvernementale) dédiée aux études et avancées en Chimie. Dans le monde entier, la norme établie pour le tableau périodique est recommandée par l'Organisation.
- Il y a 350 ans, le premier élément chimique isolé en laboratoire était le phosphore par l'alchimiste allemand Henning Brand.
- L'élément plutonium a été découvert dans les années 1940 par le chimiste américain Glenn Seaborg. Il a découvert tous les éléments transuraniens et a remporté le prix Nobel en 1951. L'élément 106 a été nommé Seaborgium en son honneur.
- En 2016, de nouveaux éléments chimiques du tableau ont été officialisés: Tennessine (Ununséptio), Nihonium (Ununtrio), Moscovium (Ununpêntio) et Oganesson (Ununóctio).
- Les nouveaux éléments chimiques synthétisés sont dits super lourds car ils contiennent un nombre élevé de protons, qui s'avère être de loin supérieur aux éléments chimiques trouvés dans la nature.
Résumé du tableau périodique
Vérifiez les questions d'examen d'entrée avec une résolution commentée dans Exercices sur le tableau périodique et des questions inédites dans Exercices sur l'organisation du tableau périodique.