Les changements d'état physique dépendent de certains facteurs liés à la température, à la pression et à la quantité d'énergie impliquée dans le processus.
Dans la nature, il existe trois états physiques de la matière: solide, liquide et gazeux. Et les changements d'état physique représentent les cinq processus de changement d'un état à un autre.
Les changements sont: condensation ou liquéfaction, solidification, fusion, vaporisation et sublimation. Chaque type de changement a ses spécificités et est lié aux qualités de la matière.
Condensation
La condensation représente le passage de l'état gazeux à liquide.
Cela se produit en raison du refroidissement d'un gaz, qui a tendance à se condenser et à devenir liquide.
Solidification
La solidification est le passage de liquide à solide.
Une matière à l'état liquide, si elle est refroidie, tend à devenir solide. Dans le cas de l'eau, la solidification se produit à 0 °C

La fusion
La fusion est le passage du état solide à liquide.
Les molécules de chaque substance ont besoin d'une certaine quantité d'énergie pour se déplacer. Quand il y a moins d'énergie, ils ont tendance à moins bouger et le matériau a tendance à être solide.
Lorsqu'ils reçoivent de l'énergie d'une source de chaleur (chauffage), ils deviennent plus agités et peuvent changer d'état.

Vaporisation
La vaporisation est le passage de état liquide à gazeux. Cela peut se produire de deux manières :
- Ébullition: chauffage rapide.
- Évaporation: chauffage lent.
De 1 °C à 100 °C, il est liquide.

Sublimation
La sublimation est le passage de état solide à gazeux C'est de état gazeux à solide (ressublimation).
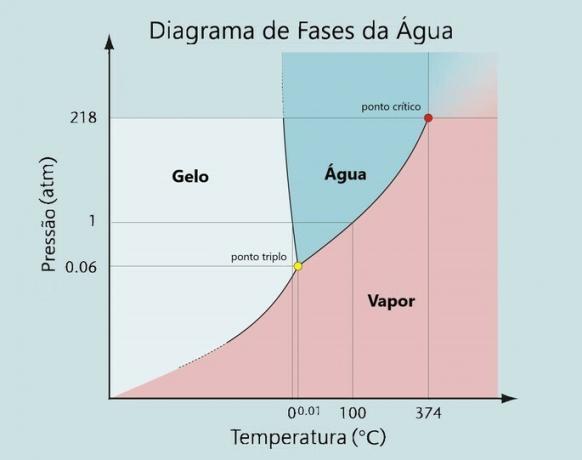
Ce type de changement se produit en fonction de certaines conditions de pression et de température. Chaque élément a son Diagramme de phases, où se situent ses courbes de fusion, de vaporisation et de sublimation.

États physiques de l'eau
L'eau se trouve facilement dans ses trois états physiques: solide, liquide et gazeux.
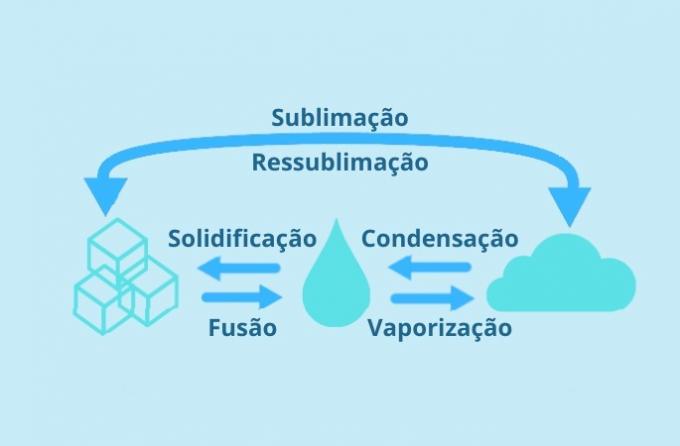
Chaque état physique de l'eau est possible en fonction des variations de température et de pression.
A pression normale (1atm), l'eau fond à 0°C et bout à 100°C.
Les molécules d'eau à -1 °C sont à l'état solide et à 0 °C, le changement (point de fusion) de la glace à 0 °C à l'eau à 0 °C se produit.
Lorsqu'il atteint une température de 100 °C, il subit un nouveau changement d'état (vaporisation), passant d'un état liquide à un état gazeux.
Comme on peut le voir sur son diagramme de phase :
Pour en savoir plus sur ce sujet, lisez aussi :
- États physiques de l'eau
- États physiques de la matière
- Transformations physiques et chimiques
- Phénomènes physiques et chimiques

