O lessive en poudre c'est un produit d'entretien qui fait partie du quotidien d'une grande partie de la population, car il est utilisé pour faciliter le lavage du linge des gens. C'est un produit qui a remplacé le savon en barre, car, lors du lavage en général, les gens avaient l'habitude de le frotter sur leurs vêtements.

Le savon en barre est encore largement utilisé dans la vaisselle, par exemple
Le savon en poudre a été fabriqué pour la première fois en 1946, après quelques tentatives pour faciliter l'utilisation du savon en barre. L'une des tentatives consistait à fabriquer le savon en flocons ou en granulés. Cependant, ces tentatives n'ont pas abouti car le savon interagit avec les ions présents dans l'eau dure, altérant principalement l'action de nettoyage.
Pourquoi ne pouvons-nous pas appeler ainsi un détergent à lessive ?
Chimiquement parlant, nous ne pouvons pas appeler ainsi un détergent à lessive. Si nous regardons l'emballage de ces produits, nous verrons qu'il est dit machines à laver, pas de lessive en poudre. Il est correct de l'appeler
Détergent en poudre, car sa composition chimique est différente de celle d'un savon.La chimie de la lessive en poudre, ou mieux, de la lessive en poudre, est basée sur la différence fondamentale entre un savon et un détergent. Voir la définition et les caractéristiques chimiques de ces matériaux :
a) Détergents :
Ce sont des substances chimiques qui ont de très longues chaînes (grande quantité de carbones) constitué uniquement d'atomes de carbone et d'hydrogène, configurant ce que nous appelons régions non polaire. Aussi, au bout de cette longue chaîne, il y a un groupe polaire.
La partie polaire du détergent est due à la présence d'un groupe sulfonate, c'est-à-dire un atome de soufre interagissant avec trois atomes d'oxygène, ou un groupe phosphate, qui a un atome de phosphore interagissant avec trois atomes de oxygène. Voir la représentation de la structure d'un détergent :
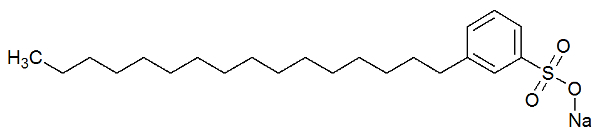
Formule développée d'un détergent
La partie polaire (formée par le sulfonate de sodium) du détergent est capable d'interagir avec les molécules d'eau. La partie non polaire (formée uniquement par des carbones et des hydrogènes) interagit avec les molécules de graisse. Ainsi, le détergent fait interagir la graisse avec l'eau et forme une émulsion.
b) Savons
sont des sels de acides carboxyliques provient de la réaction chimique entre les graisses et les bases fortes, telles que NaOH. Voir la représentation de la structure chimique du savon :
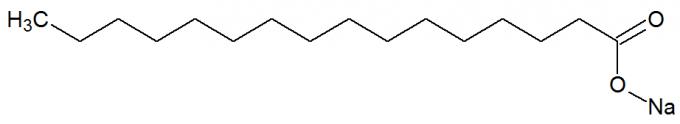
Formule développée d'un savon
Ils ont également de longues chaînes carbonées avec une partie non polaire et polaire. De cette façon, la partie non polaire (constituée uniquement de carbones et d'hydrogènes) du savon est capable d'interagir avec les graisses, et sa partie polaire (formée par le groupe COONa), avec l'eau, forme des émulsions, comme les détergents.
Comme le sujet de ce texte est la chimie de la poudre de « savon », ou plutôt, la composition chimique de la lessive en poudre, nous présentons toutes les substances chimiques qui entrent dans sa composition, ainsi que l'importance de chacune d'entre elles :
Composition chimique du détergent en poudre
tensioactif anionique (tels que l'alkylbenzènesulfonate de sodium et l'alkyléthersulfonate de sodium). Ils se lient à la molécule de graisse ainsi qu'à la molécule d'eau, éliminant ainsi la graisse du tissu ;
Enzymes : Les lipases et les protéases sont utilisées pour aider à éliminer les taches. En effet, chimiquement, les enzymes sont des catalyseurs biochimiques qui favorisent la transformation de molécules complexes en molécules plus simples. Ainsi, les molécules plus petites peuvent être plus facilement éliminées des vêtements ;
Eau de Javel (Perborate de sodium) : Il agit par oxydation, réduction ou action enzymatique. Dans l'eau, il produit du peroxyde d'hydrogène, qui est un puissant agent oxydant. Ils réagissent chimiquement avec le pigment du vêtement, modifiant la structure et entraînant un changement de couleur ;
Bloqueurs optiques: ce sont des substances qui absorbent le rayonnement ultraviolet ou la lumière ultraviolette et, peu de temps après, émettent une lumière fluorescente bleue, masquant, par exemple, la couleur jaunâtre des vêtements ;
Parfums : Ce sont des essences utilisées pour laisser une odeur agréable sur les vêtements après le processus de lavage. Il est à noter que les parfums sont des essences (ils appartiennent à la fonction ester) ;
Colorants : Substances utilisées pour colorer le produit ;
Agents séquestrants et chélateurs : L'EDTA (acide éthylènediamine tétraacétique) est un exemple de séquestrant. Ils interagissent avec les ions calcium, magnésium et fer présents principalement dans l'eau dure, ne permettant l'interaction d'aucun composant d'action nettoyante, tel que le tensioactif.
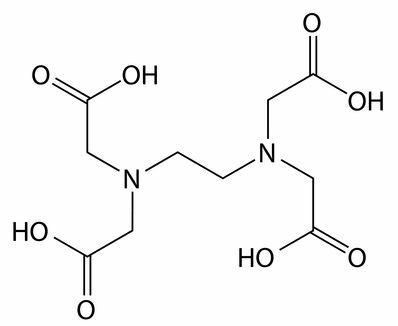
Formule développée du séquestrant EDTA
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/quimica-sabao-po.htm
