Quand on dit le mot « équilibre », un objet qui reste indéfiniment vient à l'esprit. Cependant, ce n'est qu'un type d'équilibre, appelé "équilibre statique".
Il y a aussi le "Équilibre dynamique". En lui, comme son nom l'indique, il n'y a pas un seul moment où l'objet ou le phénomène en question soit immobile. Par exemple, pour que vous compreniez, consultez l'illustration ci-dessous et notez que la quantité d'eau qui tombe dans le récipient est égale à la quantité qui en sort, en maintenant le niveau d'eau constant. Dans ce cas, on dit qu'il y a un équilibre dynamique, un équilibre en mouvement.

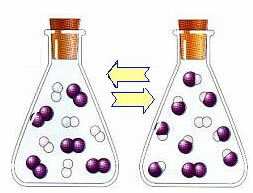
C'est ce genre d'équilibre qui se produit dans réactions réversibles, c'est-à-dire dans les réactions qui se produisent dans les deux sens. En même temps que les molécules des réactifs se transforment en produits, les molécules des produits réagissent les unes avec les autres pour former les réactifs. La réversibilité d'une réaction est représentée par des flèches dans les deux sens :
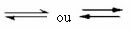
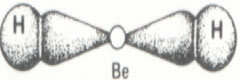
Lorsque la vitesse de développement de la réaction directe (de formation des produits) est égale à la vitesse de développement de la réaction inverse (formation de réactifs), à température constante, signifie que la réaction a atteint son équilibre chimique. Et dans le cas de réactions avec la présence uniquement de molécules dans les réactifs et les produits, on a une équilibre moléculaire.
Ce qui suit est un exemple de la réaction qui se produit entre l'hydrogène gazeux (H2) et de l'iode gazeux (I2), pour la formation d'iodure d'hydrogène (HI) gazeux :
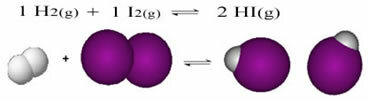
Au début de la réaction, la vitesse de développement de la réaction directe était plus élevée, après tout, la concentration des réactifs était maximale et celle des produits était nulle. Ainsi, le taux de développement de la réaction inverse était également nul.
Cependant, au fil du temps, les gaz d'hydrogène et d'iode réagissent, générant le produit. De cette façon, la concentration des réactifs commence à diminuer et leur vitesse de développement diminue également.
Au fur et à mesure que la concentration des produits augmente et que la concentration des réactifs diminue, la vitesse de développement de la réaction inverse commence à augmenter. Si la température est maintenue constante, il viendra un moment où les deux vitesses de développement resteront les mêmes, montrant ainsi que la réaction a atteint l'équilibre moléculaire chimique.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm