O rayon atomique des éléments est une propriété périodique qui détermine le rayon d'un atome qui varie en fonction de la position de l'élément dans le tableau périodique.
Ainsi, ils peuvent augmenter et diminuer au fur et à mesure numéro atomique (Z) de l'élément qui correspond au nombre de protons présents dans le noyau des atomes.
En résumé, le rayon atomique correspond à la moitié de la distance entre les noyaux de deux atomes voisins, s'exprimant ainsi :
r = d/2
d'où:
r = rayon
ré = distance internucléaire
Généralement le rayon atomique se mesure en picomètres (pm), sous-multiple du mètre (1 picomètre=10-12 m.). A noter que lorsque la référence n'est pas un atome mais un ion, le rayon trouvé est le rayon ionique.
Variation du rayon atomique
Dans le tableau périodique, la croissance du rayon atomique peut être vue dans la figure suivante:
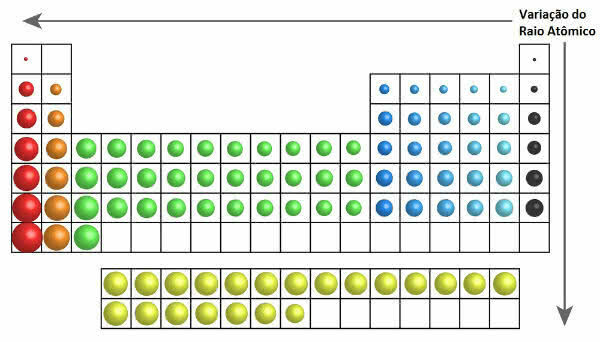 Variation du rayon atomique dans le tableau périodique
Variation du rayon atomique dans le tableau périodique
Ainsi, verticalement (familles ou groupes) le rayon atomique augmente de haut en bas. Sur l'horizontale (périodes), elles augmentent de droite à gauche.
Voir la variation inverse de Affinité électronique et électronégativité.
Énergie d'ionisation
LES énergie d'ionisation (ou potentiel) c'est aussi une propriété périodique qui détermine l'énergie nécessaire pour déplacer un électron, qui s'exprime en électron-volt (eV).
A lire aussi: Propriétés périodiques.
Vérifiez les questions d'examen d'entrée avec une résolution commentée dans: Exercices sur le tableau périodique.