Toi oxydes ils sont constitués de deux éléments différents, dont l'un est l'oxygène, qui doit être le plus électronégatif des deux.
La nomenclature des oxydes inorganiques suit des règles qui varient selon que l'oxyde est moléculaire, covalent ou ionique. Regardons chaque cas :
* Nomenclature des oxydes moléculaires ou réseau covalent :
Les oxydes de réseau moléculaire ou covalent sont ceux qui ont de l'oxygène attaché à un amétal, tels que le carbone (C), l'azote (N), le soufre (S), le fluor (F), entre autres. La nomenclature de ces oxydes suit la règle suivante :

Règle de nomenclature pour les oxydes formés avec des non-métaux
Le préfixe mono devant l'élément lié à l'oxygène est facultatif.
Par exemple, nous avons l'oxyde moléculaire suivant: CO.
- Préfixe indiquant la quantité d'oxygène: 1 oxygène: mono;
- oxyde de;
- Préfixe qui indique le nombre d'atomes de l'autre élément: 1 carbone: mono;
- Nom de l'élément lié à l'oxygène: carbone.
Alors, ton nom est comme ça: CO = monoxyde de carbone ou alors monoxyde de carbone.
Voir plus d'exemples :
dioxyde de carbone - CO2
Trioxyde de soufre - SO3
Dichloro Heptoxyde - Cl2O7
Monoxyde de diazote - N2O
Trioxyde de diazote - N2O3
Monoxyde d'azote -NO
Dioxyde d'azote - NON2
Pentoxyde de diazote - N2O5
Dioxyde de silicium - SiO2
Pentoxyde de diphosphore - P2O5
Trioxyde de soufre - SO3
* Nomenclature des oxydes ioniques :
Les oxydes ioniques sont ceux qui ont de l'oxygène lié à un métal, tels que le fer (Fe), le plomb (Pb), le sodium (Na), le calcium (Ca), l'argent (Ag), entre autres. Généralement, la charge électrique de l'oxygène est de -2.
La nomenclature mentionnée pour les oxydes à réseaux moléculaires ou covalents est également actuellement appliquée aux oxydes métalliques et est considérée comme officielle. Voir quelques exemples :
Monoxyde de fer - FeO
Monoxyde de plomb - PbO
Dioxyde de plomb - PbO2
Trioxyde différent - Fe2O3
Cependant, il existe une nomenclature spécifique pour les oxydes métalliques qui est encore largement utilisée. Elle est basée sur la valence de l'élément lié à l'oxygène.
Si l'élément a une seule valence, c'est-à-dire, s'il n'y a qu'une seule façon de lier l'oxygène et de ne former qu'un seul type d'oxyde, la règle de dénomination sera donnée par :

Règle de nommage des oxydes ioniques monovalents
Exemples:
- Oxyde de sodium - Na2O
- Oxyde de calcium - CaO
- Oxyde de potassium - K2O
- Oxyde d'aluminium - Al2O3
- Oxyde d'argent - Ag2O
Mais il existe aussi des oxydes ioniques formés par des éléments avec plus d'une valence. Dans ces cas, la règle de nommage est la suivante :
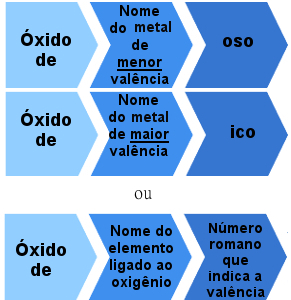
Règle de nomenclature pour les oxydes ioniques avec plus d'une valence
Exemples:
Oxyde ferreux - FeO
Oxyde ferrique - Fe2O3
Oxyde cuivreux - Cu2O
oxyde cuivrique - CuO
Ou alors:
Oxyde de fer II - FeO (Fer nox = +2)
Oxyde de fer III - Fe2O3 (Nox de fer = +3).
Oxyde de cuivre I - Cu2O (Nox de fer = +1)
Oxyde de cuivre II - CuO (Fer nox = +2).
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/nomenclatura-dos-oxidos.htm


