Certains composés ont dans leur structure des doubles liaisons alternant avec des simples liaisons. Le plus célèbre d'entre eux est le benzène, dont la structure a été proposée en 1865 par le chimiste allemand Friedrich August Kekulé (1829-1896). Sa structure serait cyclique et formée de trois doubles liaisons entrecoupées de trois simples liaisons, comme le montrent les figures ci-dessous :
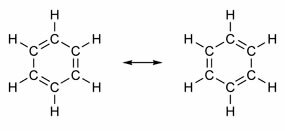
Les deux façons de représenter le benzène sont acceptables, car il est possible de changer les électrons dans les liaisons sans changer la position des atomes. Cependant, ni ne représente exactement ce qu'il est ni n'explique son comportement. Il devrait se comporter comme un alcène et provoquer des réactions d'addition, mais en pratique cela ne se produit pas. Le benzène est assez stable et agit comme s'il n'avait pas de doubles liaisons; il donne des réactions de substitution comme dans les alcanes.
En 1930, le scientifique américain Linus Pauling proposa la théorie de la résonance qui expliquait cette apparente contradiction. Cette théorie disait :
"Chaque fois que, dans une formule structurelle, nous pouvons changer la position des électrons sans changer la position des atomes, la vraie structure non ne sera aucune des structures obtenues, mais plutôt une hybride de résonance de ces structures.
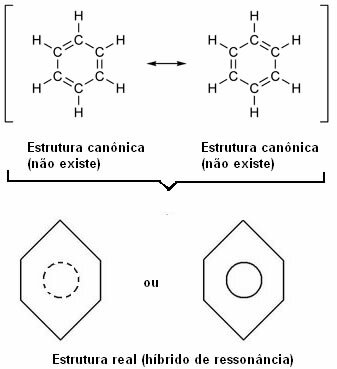
Cet effet est mis en évidence par la taille des liaisons carbone et la distance entre elles. Cette distance est intermédiaire à celle de la simple liaison (1,54 ) et à celle de la double liaison (1,34 ); étant, par conséquent, 1,39 Å, en raison de l'effet de résonance.
Cet effet peut également être vu dans la structure de la molécule d'ozone (O3), comme indiqué ci-dessous:
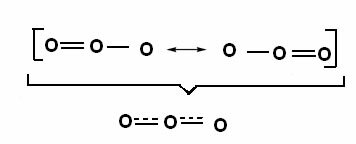
Structures canoniques et hybrides de résonance d'ozone.
Par Jennifer Fogaça
Diplômé en Chimie
Équipe scolaire du Brésil.
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm
