Le carbone est un élément chimique dont le numéro atomique (Z) est égal à 6, ce qui signifie que les atomes qui le forment ont six protons dans leur noyau. Sa masse molaire est de 12 011 g/mol et on trouve dans la nature trois isotopes du carbone qui sont: o carbone-12, carbone-13 et carbone-14. C-12 a six protons et six neutrons dans le noyau et est le plus abondant.
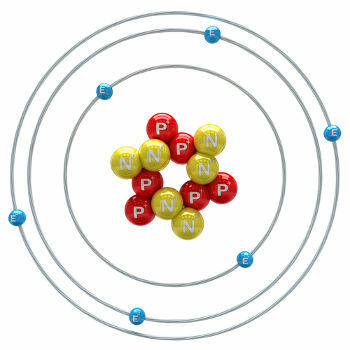
illustration de l'atome de carbone-12
Le C-13 possède sept neutrons et est le moins abondant (1,01 à 1,14 %). Le C-14 a huit neutrons et est un élément radioactif qui émet des particules (électrons), se formant dans la stratosphère terrestre lorsque les neutrons des rayons cosmiques bombardent l'azote-14 présent dans ces couches supérieures de l'atmosphère. Il est incorporé par toutes les plantes et tous les animaux et, sachant que sa demi-vie est d'environ 5730 ans, est utilisé pour déterminer l'âge des fossiles entre 100 et 40 000 ans. Plus de détails sur C-14 et la technique de datation peuvent être vus dans le texte. Qu'est-ce que le Carbone-14 ?
Le carbone est tétravalent, c'est-à-dire qu'il a besoin de quatre protons supplémentaires dans sa couche de valence (couche la plus externe) pour obéir à la règle de l'octet. Par conséquent, il établit généralement quatre liaisons covalentes, partageant quatre paires d'électrons avec d'autres éléments ainsi que d'autres carbones. Ces liaisons peuvent être simples, doubles ou triples et aboutir à la formation de millions de composés différents. Pour cette raison, un domaine de la chimie a été créé, le Chimie organique, qui étudie les principaux composés dérivés du carbone, à l'exception de quelques cas d'origine minérale comme dioxyde de carbone (CO2), ô monoxyde de carbone (CO), ô carbonate de calcium (CaCO3), l'hydrogénocarbonate de sodium ou bicarbonate de sodium (NaHCO3), entre autres. Ces composés sont étudiés dans Chimie inorganique.
Le carbone effectue l'allotropie, formant des substances simples, c'est-à-dire des substances qui ne sont formées que par des liaisons entre les atomes de carbone. Il existe au moins sept allotropes de carbone, qui sont le graphite (alpha et bêta), le diamant, la lonsdaléite (diamant hexagonal), la chaoïte, le carbone (VI) et les fullerènes. Il existe en fait plusieurs types de fullerènes, qui sont des formes allotropiques synthétiques du carbone. Ils ont une structure polyédrique avec un atome de carbone à chaque sommet et un exemple est le Ç60 appelé buckminsterfullerene, et sa structure ressemble à un ballon de football.
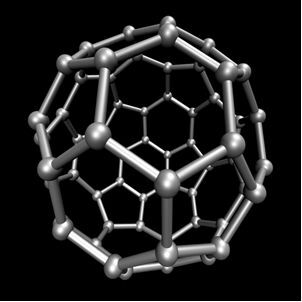
Carbone-60 (buckminsterfullerène)
Cependant, parmi ces allotropes du carbone, il n'y en a que deux qui sont naturels. graphiteC'est de diamant. Ils ne diffèrent que par la disposition cristalline des atomes dans l'espace, comme le montre la figure ci-dessous, ce qui se traduit par des propriétés physico-chimiques totalement différentes. Lisez le texte allotropie du carbone pour plus d'informations.

Les deux formes allotropiques naturelles du carbone sont le graphite et le diamant.
Une autre forme allotropique synthétique du carbone est le nanotubes (image ci-dessous) qui ont de larges applications biologiques, y compris les diagnostics et les traitements médicaux.

Illustration d'un nanotube de carbone microscopique
Ainsi, le carbone est présent dans tout ce qui nous entoure et en nous, parce qu'il compose composés organiques naturels — tels que les combustibles fossiles, qui comprennent le pétrole, le charbon et le gaz naturel, et d'autres combustibles tels que l'éthanol et les biocarburants — produits agricoles, entre autres. forme aussi composés organiques synthétiques, tels que les fibres synthétiques qui composent les tissus, les médicaments, les polymères qui composent les plastiques et les caoutchoucs, les insecticides, les colorants et bien plus encore. En nous, animaux et végétaux, le carbone forme des composés très importants, comme les glucides, comme le sucre, le glucose et la cellulose; les protéines qui forment, par exemple, l'ADN et, avec les lipides, forment les membranes des globules rouges et des globules blancs.
Tout cela montre l'importance du carbone pour le maintien de la vie. Mais il a également été associé à des aspects négatifs, tels que l'intensification de la Effet de serre et le conséquent réchauffement climatique, c'est parce que le principal méchant de ces problèmes est son composé de dioxyde de carbone (CO2). Principalement en raison de la combustion importante de combustibles fossiles qui libèrent ce gaz, la concentration de CO2 dans l'atmosphère a augmenté. En tant que gaz à effet de serre, il provoque les problèmes susmentionnés. D'autre part, le dioxyde de carbone est également présent dans des réactions vitales telles que la photosynthèse et la respiration.
Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-carbono.htm