Les hydrocarbures, également appelés carbures d'hydrogène, sont des composés organiques dont la composition ne comporte que des atomes de carbone (C) et de hydrogène (H), ayant ainsi la formule générale CXHoui.
Un hydrocarbure est constitué d'une structure carbonée à laquelle des atomes d'hydrogène se lient en une liaison covalente.
C'est le composé le plus important de la chimie organique.
Tous les types d'hydrocarbures s'oxydent facilement, libérant ainsi de la chaleur. La plupart d'entre eux ne sont pas solubles dans l'eau.
Les hydrocarbures naturels sont des composés chimiques formés à l'intérieur de la Terre (à plus de 150 km de profondeur) à haute pression et atteindre des zones de basse pression par des processus géologiques.
Où trouve-t-on des hydrocarbures ?
La principale source d'hydrocarbures est le pétrole. De ce fait, l'hydrocarbure est présent dans plusieurs dérivés tels que kérosène, paraffine, gaz naturel, De l'essence, Vaseline, diesel, GPL (Gaz de pétrole liquéfié), polymères (comme le plastique et le caoutchouc), entre autres.
Ce composé organique constitue 48% de la matrice énergétique du Brésil.
La chaîne carbonée qui entre dans la composition d'un hydrocarbure est tétravalent, c'est-à-dire qu'il peut établir quatre connexions.
Le carbone est capable de se lier à d'autres atomes de carbone et à des hydrogènes par liens simples, double ou alors triplé.
Classification des hydrocarbures
La classification des hydrocarbures repose sur trois spécificités: une forme de la chaîne carbonée principale, le Connexions des chaînes carbonées, le présence de radicaux alkyles dans la chaîne carbonée et présence d'hétéroatomes divisant la chaîne carbonée.
en savoir plus sur hydrogène.
Forme principale de la chaîne de carbone
En ce qui concerne la forme de la chaîne carbonée principale, la classification des hydrocarbures est subdivisée en aliphatique et cyclique.
Découvrez en quoi consiste chacune de ces formes de chaîne carbonée.
hydrocarbures aliphatiques
Les hydrocarbures aliphatiques sont formés par des chaînes carbonées ouvert ou alors acyclique. Dans ces chaînes, les carbones sont terminaux.
Exemples:
hydrocarbure
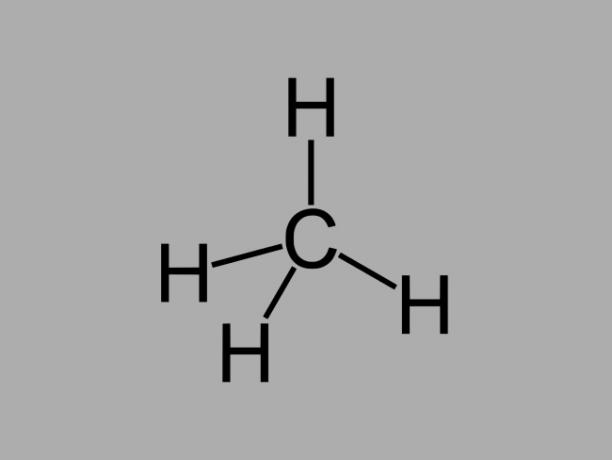
Les hydrocarbures alcanes, également appelés paraffines ou alors paraffinique, sont des composés huileux où il n'y a que des liaisons simples entre les carbones.
La formule générale d'un alcane est CnonH2non + 2 (n = tout nombre entier).
alcène
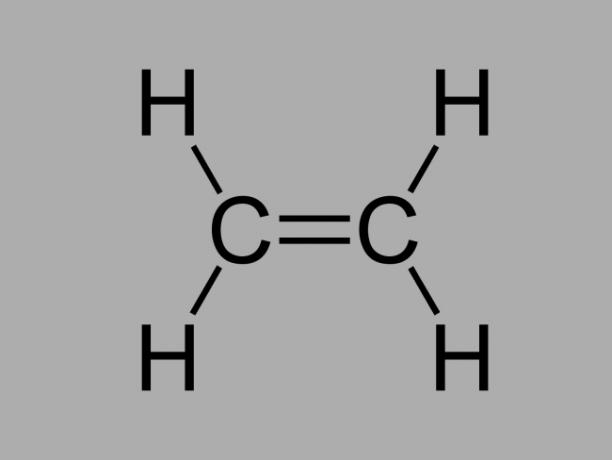
Aussi appelé oléfine, alcène ou alors éthylène hydrocarbure, l'alcène est un composé peu réactif où il existe une double liaison entre les carbones.
La formule générale d'un alcène est CnonH2non.
alcyne
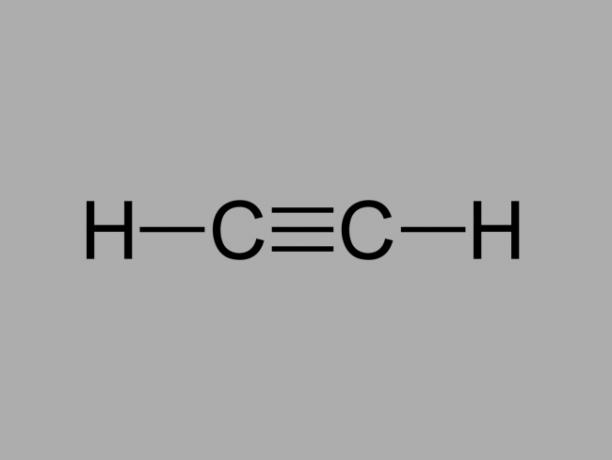
Aussi appelé méthylacétylène, l'alcyne est un hydrocarbure où les liaisons existantes entre les carbones sont triples.
La formule générale d'un alcyne est CnonH2non-2.
alcadiène

Aussi appelés diènes ou dioléfines, les alcadiènes sont des hydrocarbures où les liaisons entre les carbones sont doubles.
La formule générale d'un alcadiène est CnonH2non-2.
Hydrocarbures cycliques
Les hydrocarbures cycliques sont formés par des chaînes carbonées fermées ou cycliques. Ces chaînes n'ont pas de carbones terminaux.
Exemples:
Cyclane
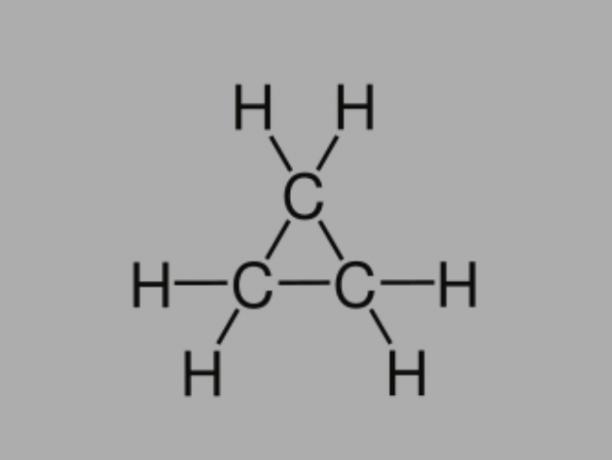
Aussi appelé cycloalcane, cycloparaffine ou alors hydrocarbure naphténique, le cyclane est un hydrocarbure saturé, composé de liaisons simples.
Il a une chaîne carbonée fermée et sa formule générale est CnonH2non.
Cyclonique

Aussi appelé cycloalcènes, les cyclènes sont des hydrocarbures insaturés, composés de doubles liaisons.
Un cyclène a une chaîne carbonée fermée et sa formule générale est CnonH2non−2.
cycliste
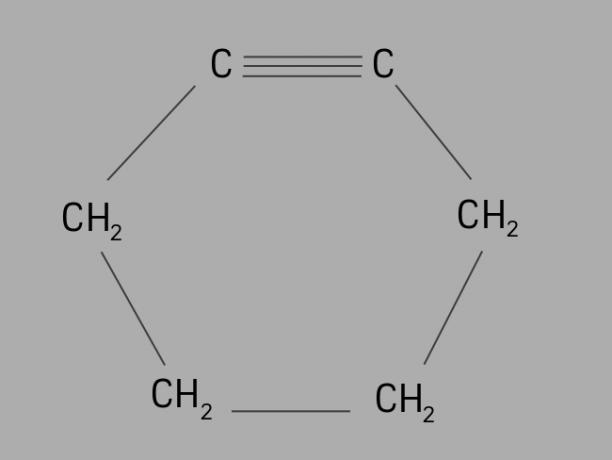
Aussi appelé cycloalcyne ou alors cycloalcyne, la cycline est un hydrocarbure cyclique et insaturé.
Il est formé d'une chaîne carbonée fermée, avec des triples liaisons et sa formule générale est CnonH2non-4.
Aromatique

ou alors

Aussi appelé arènes, les hydrocarbures aromatiques sont des composés insaturés formés par des doubles liaisons.
Un aromatique a une chaîne carbonée fermée ou cyclique et sa formule générale est C6H6.
Type de liaison des chaînes carbonées
Selon le type de liaison des chaînes carbonées, les hydrocarbures peuvent être classés en saturé ou alors insaturé.
Voir ci-dessous en quoi consiste chacune de ces classifications.
Hydrocarbures saturés
Les hydrocarbures saturés sont formés par liens simples.
Exemples: alcanes, cyclanes.
hydrocarbures insaturés
Les hydrocarbures insaturés sont formés par doubles liaisons ou alors triplé.
Exemples: alcènes, alcynes, alcadiènes.
Présence de radicaux alkyles
Concernant la présence de radicaux alkyles, les hydrocarbures peuvent avoir une chaîne carbonée Ordinaire ou alors ramifié.
chaîne carbonée normale
Un hydrocarbure à chaîne carbonée normale n'a pas de radicaux alkyle.
Exemple: pentane
chaîne carbonée ramifiée
Lorsqu'un hydrocarbure a une chaîne carbonée ramifiée, cela signifie que sa chaîne carbonée principale a des radicaux alkyles.
Exemple: méthylpropane
Présence d'hétéroatomes divisant la chaîne carbonée
La chaîne carbonée séquentielle peut être scindée ou non en fonction de la présence d'hétéroatomes.
Chaîne carbonée homogène
Lorsqu'un hydrocarbure a une chaîne carbonée principale homogène, cela signifie que cette chaîne n'est pas divisé par des hétéroatomes.
Chaîne carbonée hétérogène
Si un hydrocarbure a une chaîne carbonée principale hétérogène, cette chaîne avait son chaîne de carbone fendue par un hétéroatome.
Nomenclature des hydrocarbures
La nomenclature des hydrocarbures est définie par une combinaison de trois parties :

Le préfixe identifie la quantité de carbones, l'intermédiaire identifie le type de liaison et le suffixe indique la fonction à laquelle appartient le composé (dans ce cas, la classe des hydrocarbures).
Voir ci-dessous pour la liste des préfixes et intermédiaires qui sont combinés pour désigner les hydrocarbures.
Liste des préfixes
| Nombre de carbones | Préfixe |
|---|---|
| 1 | Rencontré- |
| 2 | Et- |
| 3 | Soutenir- |
| 4 | Mais- |
| 5 | pent- |
| 6 | Hex- |
| 7 | Hept- |
| 8 | Oct- |
| 9 | Non- |
| 10 | Déc- |
Liste des intermédiaires
| Type de connexion | Intermédiaire |
|---|---|
| Juste des appels simples | -un- |
| Paire | -fr- |
| tripler | -dans- |
| deux paires | -dien- |
Regardez quelques exemples de nommage d'hydrocarbures.
Exemples:
CH3 – CH2 – CH2 – CH3
Dans la forme structurelle ci-dessus, nous pouvons voir un composé à 4 carbones qui n'a que des liaisons simples (indiquées par le symbole « - »).
- Préfixe pour 4 carbones = mais-
- Intermédiaire pour une liaison simple = -an-
- Suffixe d'un hydrocarbure= -o
Voir que l'union de préfixe + intermédiaire + suffixe donne naissance au nom BUTANE.
CH2 = CH2
La forme structurelle ci-dessus a 2 carbones et 1 double liaison (indiquée par le symbole "=").
- Préfixe pour 2 carbones = et-
- Intermédiaire pour les doubles liaisons= -en-
- Suffixe d'un hydrocarbure= -o
Voir que l'union de préfixe + intermédiaire + suffixe donne naissance au nom ÉTHÈNE.
CH2 = CH - CH2 – CH3
CH3 – CH = CH2 – CH3
Notez que les deux formes structurelles ci-dessus ont 4 carbones et 1 double liaison (indiquée par le symbole "=").
Ainsi, nous avons :
- Préfixe pour 4 carbones = mais-
- Intermédiaire pour les doubles liaisons= -en-
- Suffixe d'un hydrocarbure= -o
Voir que l'union de préfixe + intermédiaire + suffixe donnerait naissance au nom BUTÈNE pour les deux formes structurelles.
Cependant, notez que les formes structurelles ne sont pas identiques, donc les nomenclatures ne peuvent pas l'être non plus.
La différence entre les deux formes structurelles réside dans l'emplacement de la double liaison.
Dans ce cas, il faut numéroter les carbones de la chaîne en partant de l'extrémité la plus proche du double. Par conséquent, dans les cas en question, nous devons numéroter de gauche à droite.
Dans CH2 = CH - CH2 – CH3:
- CH2 sera le 1
- CH sera le 2
- CH2 sera le 3
- CH3 sera le 4
Notez que le double liaison est entre le carbone 1 C'est le carbone 2.
Il faut utiliser le plus petit nombre (1) pour trouver la double liaison: BUTÈNE -1
Dans CH3 – CH = CH2 – CH3:
- CH3 sera le 1
- CH sera le 2
- CH2 sera le 3
- CH3 sera le 4
Notez que la double liaison est entre le carbone 2 C'est le carbone 3.
Il faut utiliser le plus petit nombre (2) pour trouver la double liaison: BUTENE -2
Selon IUPAC (Union internationale de chimie pure et appliquée – Union internationale de chimie pure et appliquée), l'emplacement doit être indiqué légèrement avant le étant localisé (dans le cas des formals structurels ci-dessus, la double liaison, représentée par l'intermédiaire "-fr-").
Avec cela, nous avons une deuxième façon, qui d'ailleurs est la plus correcte, d'écrire la nomenclature des formes structurelles disponibles.
CH2 = CH - CH2 – CH3: BUTENE -1 ou BUT-1-ENO (forme plus correcte)
CH3 – CH = CH2 – CH3: BUTENE -2 ou BUT-2-ENE (forme plus correcte)
En savoir plus sur IUPAC et nomenclature.