Comme expliqué dans le texte « Types de forces intermoléculaires », les molécules de substances dans les trois états physiques (solide, liquide et gazeux) sont attirées par l'une des forces intermoléculaires.
Les trois forces intermoléculaires connues sont: dipôle induit - dipôle induit, dipôle permanent - dipôle permanent et liaison hydrogène. Parmi eux, la liaison hydrogène est la plus forte. Certains auteurs appelaient cette force intermoléculaire des liaisons hydrogène; cependant, le terme correct accepté par l'IUPAC est « liaison hydrogène ».
Ce type d'interaction se produit lorsque l'hydrogène de la molécule est lié au fluor, à l'azote ou à l'oxygène, qui sont des atomes fortement électronégatifs.

La liaison hydrogène est un exemple extrême de la liaison dipôle permanent-dipôle permanent. Car l'hydrogène d'une molécule constitue un pôle positif, qui se lie à l'un de ces atomes de fluor, d'oxygène ou d'azote d'une autre molécule, qui constituent leur pôle négatif.
Normalement, des liaisons intermoléculaires se produisent avec des substances à l'état liquide et solide. De plus, comme il s'agit d'une force d'attraction très intense, il faut une très grande énergie pour la briser.
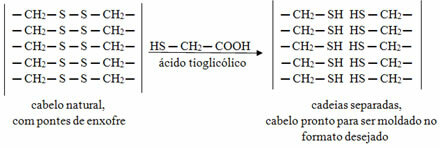
Une substance qui a cette force intermoléculaire est l'eau elle-même. Notez comment cela se produit dans l'illustration ci-dessous :

Notez que chaque molécule d'eau est spatialement entourée par quatre autres molécules d'eau, avec les liaisons d'hydrogène se produisent par la liaison entre l'hydrogène d'une molécule (pôle positif) avec l'oxygène d'une autre (pôle négatif).
Les liaisons hydrogène expliquent divers phénomènes dans la nature, voir les exemples suivants :
- Le fait que la glace flotte sur l'eau : La glace est moins dense que l'eau et par conséquent flotte dessus. En effet, alors qu'à l'état liquide, les liaisons hydrogène qui se produisent entre les molécules d'eau sont disposées de manière désorganisée, les liaisons hydrogène dans le les molécules de glace sont plus espacées et organisées, formant une structure hexagonale rigide, ce qui fait que les molécules occupent un espace beaucoup plus grand qu'elles ne le feraient si elles étaient en l'état. liquide.

Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
C'est même pourquoi si on met de l'eau dans le plein volume d'une bouteille et qu'on la met plus tard dans une glacière, son volume va augmenter et la bouteille va se fissurer.
Ainsi, il y aura la même quantité de molécules par unité de volume, ce qui diminue la densité, selon la formule de densité: d = m/v. Il y aura des espaces vides entre les hexagones formés, diminuant la densité de cette substance.
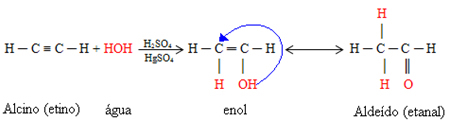
- Ionisation acide : Bien que les liaisons hydrogène soient environ dix fois plus faibles que les liaisons covalentes; dans certaines circonstances, ils parviennent à rompre les liaisons covalentes. Par exemple, dans le cas illustré ci-dessous, l'acide chlorhydrique est dissous dans l'eau. L'oxygène dans l'eau attire l'hydrogène lié au chlore de l'acide plus que le chlore lui-même, donnant lieu à des ions hydronium (H3O+) et le chlorure (Cl-). Ce phénomène est appelé ionisation :

- Tension superficielle de l'eau : les molécules à la surface du liquide ne sont attirées par les liaisons hydrogène qu'avec les molécules à côté et en dessous, car il n'y a pas de molécules au-dessus. Les molécules qui sont sous la surface, d'autre part, effectuent ce type de liaison avec des molécules dans tous les directions, le résultat est la formation d'une sorte de film ou de couche mince à la surface de l'eau, qui implique.

Cela explique le fait que des insectes puissent y rester et aussi le phénomène de la forme sphérique des gouttelettes d'eau.

Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Liaisons hydrogène »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/ligacoes-hidrogenio.htm. Consulté le 27 juin 2021.
Chimie

Pollution de l'eau, aspects physiques de l'eau, aspects chimiques de l'eau, aspects biologiques de l'eau, déchets industriels, métaux lourds, eau potable, matière organique, turbidité de l'eau, eaux usées.