Dans le texte "Relation entre polarité et solubilité des substances", vous avez vu que généralement les solutés les substances polaires se dissolvent dans les solvants qui sont également polaires et que les substances non polaires se dissolvent également dans les solvants non polaire. Cependant, ce n'est pas une règle qui peut s'appliquer à tous les cas de solubilité.
Par exemple, le sucre se dissout dans l'eau, mais pas l'huile. Il est vrai que les molécules d'eau et de sucre sont polaires, tandis que les molécules d'huile sont non polaires, mais ce sont les types de forces intermoléculaires entre les molécules de ces substances isolées et les autres qui nous fournissent l'explication de ce fait.

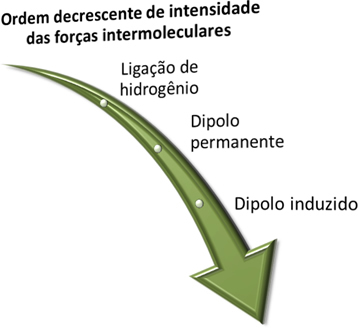
Avant de voir quelles sont ces forces, rappelez-vous qu'en termes d'intensité, plus forte est la liaison hydrogène, qui est suivie par la force dipolaire permanente et la plus faible est la force dipolaire induite.
Les molécules d'eau et de sucre (saccharose - C12H22O11), présentent des atomes d'oxygène liés à des atomes d'hydrogène, formant des groupes ─ O ─ H. Cela signifie que
entre les molécules d'eau et entre les molécules de sucre, il peut y avoir des interactions de liaison hydrogène intermoléculaires.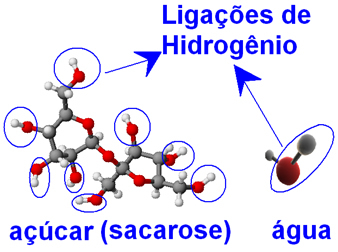
C'est pourquoi les molécules d'eau sont capables d'envelopper les molécules de sucre qui étaient étroitement liées entre elles sous forme de cristaux et de les séparer, les empêchant de se rejoindre. Ainsi, le sucre a une grande solubilité dans l'eau, et on peut en dissoudre jusqu'à 33 g dans 100 g d'eau à 20ºC.
Maintenant, l'huile et l'eau ne sont pas miscibles. Cela ne veut pas dire que l'huile n'est pas attirée par l'eau, car le fait qu'elle s'étale à la surface de l'eau plutôt que d'avoir la forme sphérique, nous révèle qu'il recherche une forme dans laquelle une plus grande quantité de molécules d'huile sont en contact avec les molécules d'huile. L'eau.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
cependant, l'attraction entre les molécules d'eau est beaucoup plus grande (liaison hydrogène) que l'attraction entre les molécules d'huile et d'eau. Par conséquent, les molécules d'huile ne peuvent pas rompre la liaison entre deux molécules d'eau voisines.
Ceci nous amène à conclure que :
« Si la force intermoléculaire existante est plus intense que la nouvelle interaction possible, alors le soluté ne se solubilise pas, la liaison d'origine restant. Mais si la nouvelle interaction est plus forte, le soluté se solubilisera, brisant les liaisons intermoléculaires des substances.
Un autre exemple qui nous montre l'importance des forces intermoléculaires pour la solubilité des matériaux est celui de l'iode, de l'eau et du benzène. Dans le schéma ci-dessous, nous avons que l'iode se dissout bien dans le benzène et est légèrement soluble dans l'eau, l'eau et le benzène sont totalement non miscible et quand on a un mélange de benzène et d'eau et qu'ensuite on ajoute l'iode, il ne se dissout que dans le benzène:
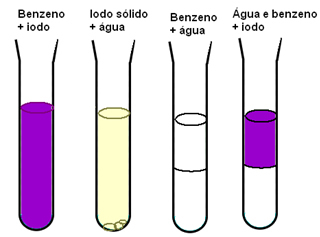
Le benzène et l'iode sont non polaires et se mélangent plus facilement que l'eau, qui est polaire. Mais ce qui explique vraiment ce qui se passe, c'est que les forces dipolaires induites intermoléculaires existant entre les molécules non polaires sont faibles par rapport aux liaisons hydrogène de l'eau.
Par conséquent, étant donné que les interactions existantes entre les molécules d'eau sont plus fortes que les nouvelles possibles interactions, les liaisons hydrogène ne sont pas rompues et un système à deux phases est observé lors du mélange du benzène et L'eau.
Les nouvelles interactions qui se forment entre les molécules d'iode et les molécules de benzène sont plus intenses que celles qui se produisent entre les molécules de ces substances isolées.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Relation entre la force intermoléculaire et la solubilité des substances »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/relacao-entre-forca-intermolecular-solubilidade-das-substancias.htm. Consulté le 27 juin 2021.