Utiliser une ampoule de Crookes, c'est-à-dire des tubes de verre fermés avec une électrode positive et une électrode négative, contenant des gaz à des pressions extrêmement basses; le scientifique anglais Joseph John Thomson (1856-1940) a fait une découverte essentielle pour l'évolution du modèle atomique.
Il soumet ces gaz à des tensions extrêmement élevées, ainsi il est possible d'observer l'apparition d'émissions, que l'on appelle rayons cathodiques. Ensuite, un champ électrique externe a été placé et, enfin, il a été vérifié que le faisceau de rayons cathodiques était dévié, allant toujours dans la direction et la direction de la plaque chargée positivement. Par conséquent, ces émissions avaient des charges négatives.
Un autre point important est que quel que soit le gaz utilisé, c'était toujours le même; ainsi Thomson est arrivé à la conclusion logique que ces charges négatives étaient présentes dans n'importe quelle matière, en faisaient partie intégrante. Ainsi, il a été prouvé que, contrairement à ce que Dalton avait déclaré, l'atome n'était pas indivisible, car il avait une particule subatomique négative, qui a été nommée
Séquentiellement, en 1886, un autre scientifique, nommé Eugen Goldstein, a découvert le rayons d'anode ou alors chaînes, qui étaient des rayons chargés positivement, formés par ce qui restait des atomes du gaz dont les électrons avaient été arrachés par la décharge électrique. Ces rayons étaient connus pour posséder charge positive parce qu'ils étaient déviés dans la direction opposée des rayons cathodiques, c'est-à-dire qu'ils étaient attirés par la plaque négative.
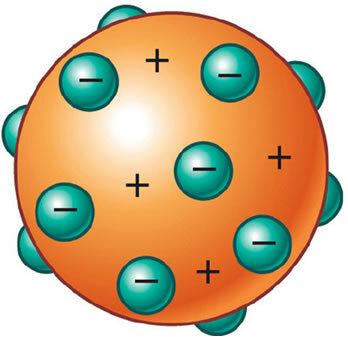
On découvrit alors que l'atome avait aussi une partie positive, qui était même nécessaire pour maintenir sa neutralité électrique. Ainsi, J. J. Thomson a proposé un nouveau modèle pour l'atome, baptisé le "pouding aux raisins" ou alors "Plum Pudding". Ce serait une sphère non massive chargée positivement incrustée d'électrons (négatifs) de sorte que sa charge électrique totale est nulle.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Par Jennifer Fogaça
Diplômé en Chimie
Équipe scolaire du Brésil
Chimie générale - Chimie - École du Brésil
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Expérience de Thomson avec les décharges électriques »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/o-experimento-thomson-com-descargas-eletricas.htm. Consulté le 27 juin 2021.