Une réaction de substitution il est basé sur l'échange entre les composants de deux réactifs différents. Les composés avec une plus grande stabilité (saturés, c'est-à-dire avec seulement des liaisons simples entre les carbones) sont plus susceptibles de subir ce processus. Cependant, le benzène peut aussi le faire.
Nous savons que dans la structure du benzène il y a trois doubles liaisons (trois liaisons pi), c'est-à-dire que ce composé est insaturé, mais ces doubles subissent le phénomène de résonance (alternance de position des trois liaisons pi) tout le temps. Pour cette raison, sa structure a une plus grande stabilité, car les liaisons transitent par tous les carbones.
Les réactions de substitution qui peuvent se produire dans le benzène sont :
Halogénation;
Nitration;
Sulfonation;
Alkylation;
Acylation.
a) Halogénation
Dans cette réaction, le benzène interagit avec les halogènes (Br2, Cl2 Hey2), toujours en présence d'un catalyseur, qui peut être un sel inorganique (AlCl3, FeCl3 et février3
). Le processus se produit avec l'échange d'un hydrogène benzénique contre un atome d'halogène. Le résultat est le formation d'un halogénure organique et un hydrure halogéné. Voir un exemple :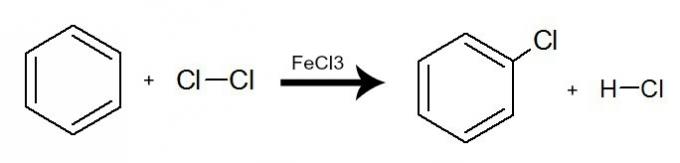
Équation représentant une halogénation du benzène par l'utilisation de chlore moléculaire (Cl2)
b) Nitratation
Dans cette réaction, le benzène interagit avec l'acide nitrique (HNO3), toujours en présence du catalyseur acide sulfurique (H2SEUL4) et le chauffage. Le processus se produit avec l'échange d'un hydrogène du benzène pour le groupe NO2 de l'acide. Le résultat est le formation d'un composé nitro et de l'eau.
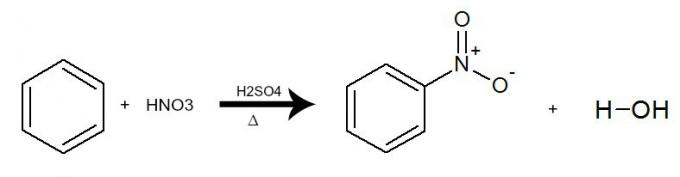
Équation représentant la nitration du benzène par l'utilisation d'acide nitrique
c) Sulfonation
Dans cette réaction, le benzène interagit avec l'acide sulfurique (H2SEUL4), toujours en présence du catalyseur trioxyde de soufre (SO3) et le chauffage. Le processus se produit avec l'échange d'un hydrogène du benzène par le groupe SO3H d'acide. Le résultat est le formation de acide sulfonique et de l'eau.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
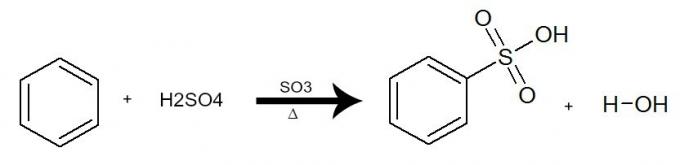
Équation représentant une sulfonation du benzène en utilisant de l'acide sulfurique
d) Alkylation
Dans cette réaction, le benzène interagit avec un halogénure organique (R-X), toujours avec la présence du catalyseur trichlorure d'aluminium (AlCl3) et le chauffage. Le processus a lieu avec l'échange d'un hydrogène du benzène par le groupe R (substituant organique) de l'halogénure. Le résultat est le formation d'un hydrocarbure aromatique ramifiéet un acide inorganique (HX).
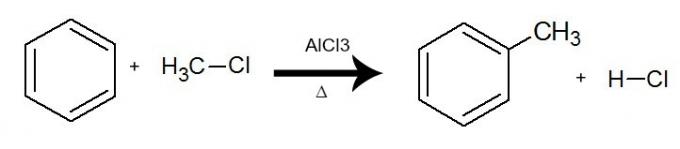
Équation représentant une alkylation du benzène en utilisant du chlore méthane
e) Acylation
Dans cette réaction, le benzène interagit avec un halogénure d'acide, qui peut être représenté par le chlorure d'éthanoyle :
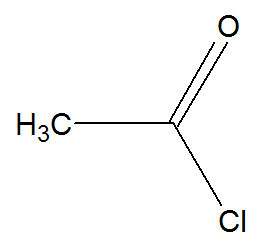
Formule développée du chlorure d'éthanoyle
La réaction se produit en présence de catalyseur trichlorure d'aluminium (AlCl3) et il y a un échange d'un hydrogène du benzène pour l'ensemble du groupe halogénure d'acide (à l'exception de X-halogène). Le résultat est le formation d'un cétone et un acide inorganique (HX). Voir un exemple :
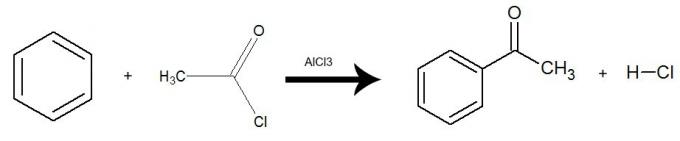
Équation représentant une acylation du benzène en utilisant du chlorure d'éthanoyle
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. « Réactions de substitution dans le benzène »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/reacoes-substituicao-no-benzeno.htm. Consulté le 27 juin 2021.
Chimie

Composés aromatiques, arènes, polarité, solvants insolubles, solubles, non polaires, éther, tétrachlorure de carbone, hydrocarbures, insecticides, colorants, solvants, explosifs, cancérigènes, toluène, méthylbenzène, médicaments, colle cordonnier.
Chimie

Cliquez ici pour en savoir plus sur la réaction de substitution, un processus chimique dans lequel les réactifs (organiques et inorganiques) utilisés échangent l'un de ses composants entre eux, formant de nouvelles substances. Parmi les substances les plus utilisées comme réactifs figurent les alcanes, le benzène et les halogénures organiques.