Les concepts de processus réversibles et irréversibles peuvent être décrits mathématiquement en utilisant le concept d'entropie. Mais avant d'aborder la définition de l'entropie, passons aux concepts de processus réversibles et irréversibles. nous appelons processus réversible celui dans lequel le système peut revenir spontanément à la situation (ou état) d'origine. Processus irréversible est celui dont le système ne peut pas revenir spontanément à son état d'origine.
Les concepts de types de processus ayant déjà été évoqués, passons à la définition de l'entropie. LES entropie d'un système (S) est une mesure de son degré de désorganisation. Plus l'organisation est grande, plus l'entropie est faible. L'entropie est une caractéristique de l'état thermodynamique, tout comme l'énergie interne, le volume et le nombre de moles.
En regardant les conteneurs dans la figure ci-dessus, nous voyons que le conteneur 1 a un entropie plus petit que l'autre. Si nous prenons le récipient et le secouons, nous vérifierons que les "boules" seront mélangées, ou plutôt désorganisées. Si nous vérifions le conteneur 2, après l'avoir secoué, nous remarquerons que ce n'est pas possible pour les balles, spontanément, retournent à leur organisation d'origine, si nous continuons à ébranler les récipient.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Dans les processus réversibles isothermes réversibles (dont la température reste toujours la même), nous définissons l'entropie comme le rapport de la chaleur (donnée ou reçue) à la température. Ainsi, nous représentons l'entropie dans les processus isothermes comme suit :
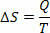
Dans le Système international d'unités, nous mesurons l'entropie en joule/kelvin. Sur la base du concept que nous décrivons à propos de l'entropie, nous pouvons formuler la deuxième loi comme suit :

Le changement d'entropie d'un système isolé est toujours positif ou nul. L'égalité ΔS = 0 se produit lorsque les processus sont réversibles: les processus réversibles n'augmentent pas l'entropie. Les systèmes isolés, qui ne reçoivent ni ne donnent de chaleur à l'environnement, ne peuvent qu'augmenter ou maintenir constante leur entropie.
Par Domitiano Marques
Diplômé en Physique
Équipe scolaire du Brésil
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
SILVA, Domitiano Correa Marques da. « L'entropie et la deuxième loi »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/fisica/entropia-segunda-lei.htm. Consulté le 27 juin 2021.