Nous verrons dans ce texte comment un tableau de changement d'état physique à n'importe quel substance pure, comment interpréter ce type de schéma et comment est représenté le graphe des mélanges.
Pour ce faire, prenons l'exemple de l'eau. Imaginez que nous prenons un verre de glace à une température de –10 ºC et commençons un processus de chauffage, sous une pression de 1 atm. Au fur et à mesure que la température augmente, passant de -10 ºC à -9 ºC, à -8 ºC et ainsi de suite, la glace restera à l'état solide jusqu'à ce qu'elle atteigne une température de 0 ºC.
À ce stade, il commence à passer à l'état liquide, c'est-à-dire que la fusion commence à avoir lieu. La température ne continuera pas à augmenter comme avant, mais restera constante à 0°C jusqu'à ce que toute la glace ait fondu :

Après avoir fait fondre tout le solide, la température du système va continuer à augmenter jusqu'à atteindre une température de 100°C. À cette température, l'eau qui était à l'état liquide commencera à passer à l'état de vapeur, c'est-à-dire qu'elle bouillira.
Tout comme cela s'est produit dans le point de fusion, au point d'ébullition, la température restera également constante jusqu'à ce que tout le liquide se transforme en vapeur. Après cela, si nous continuons à chauffer le système, la température continuera à augmenter :
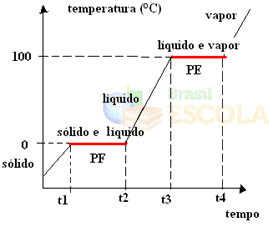
Prêt! Il s'agit du graphique ou du diagramme qui représente l'évolution de l'état physique de l'eau ou de sa courbe de chauffe. S'il s'agissait du processus inverse, nous aurions la courbe de refroidissement par eau suivante :
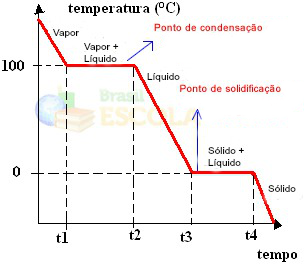
Un aspect très important de ces graphiques est qu'ils sont formés de deux niveaux, c'est-à-dire qu'il y a deux points où la température reste constante pendant un certain temps. Cela se produit toujours dans le changement d'état d'une substance pure. La seule différence réside dans les valeurs de point de fusion et d'ébullition.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
L'oxygène, par exemple, contrairement à l'eau, n'est pas un liquide, mais un gaz à température ambiante (environ 20ºC). En effet, son point de fusion au niveau de la mer est de -223,0 °C et son point d'ébullition est de -183,0 °C. Consultez votre tableau de changement d'état physique :

Graphiques de mélange communs
Si nous chauffons ou refroidissons un mélange, le point de fusion et le point d'ébullition n'auront pas des valeurs déterminées et constantes, c'est-à-dire que les deux niveaux observés dans les graphiques ne seront pas formés dessus.
Les changements d'états physiques se produiront sur des plages de température plutôt que sur une quantité fixe. Le point de fusion, par exemple, commencera à une température donnée et se terminera à une autre, et il en sera de même avec le point d'ébullition, comme le montre le graphique suivant :
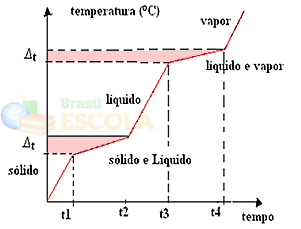
Deux exceptions sont les mélanges eutectiques et azéotropiques. Voyez ce qui leur arrive :
a) Mélange eutectique
Le mélange eutectique se comporte comme s'il s'agissait d'une substance pure lors de la fusion, c'est-à-dire qu'à ce stade, la température reste constante du début à la fin du changement d'état d'agrégation.

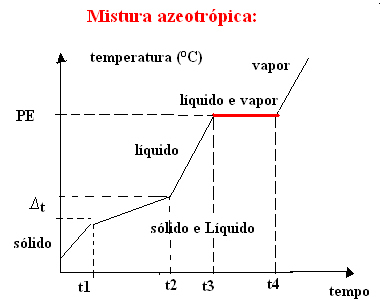
b) mélange azéotropique
Le mélange azéotropique se comporte comme une substance pure lors de l'ébullition, c'est-à-dire qu'à ce stade, la température reste constante du début à la fin du changement d'état d'agrégation.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Graphiques des changements d'état physique »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/graficos-mudanca-estado-fisico.htm. Consulté le 28 juin 2021.