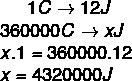introduction
Un corps, lorsqu'il reçoit une certaine quantité d'énergie thermique, peut faire varier sa température ou son état physique, c'est-à-dire solide, liquide et gazeux. La variation de température se produit en raison de l'agitation accrue des particules qui composent le corps, dans ce cas la quantité de chaleur que le corps a reçue est appelée chaleur sensible. Si le corps change d'état physique à température constante, on dit que la quantité de chaleur est appelée chaleur latente. Mais qu'est-ce que la chaleur? Comment est-il transféré?
Chaleur est l'énergie thermique en transit, qui est déterminée par la différence de température entre les systèmes impliqués. La chaleur circule du corps à température plus élevée vers le corps à température plus basse et peut être transférée d'un corps à un autre des manières suivantes: conduction, convection et irradiation. Le terme chaleur est utilisé pour indiquer l'énergie transférée. Indiqué par la lettre Q, l'unité de chaleur dans le Système international d'unités est le joule (J), du nom du physicien anglais James Prescott Joule. Cependant, l'unité la plus utilisée est la calorie (cal), cependant on peut la rapporter au joule comme suit:
Capacité thermique et chaleur spécifique
En supposant qu'il n'y ait pas de changement d'état physique, imaginez un corps qui reçoit une certaine quantité d'énergie et change sa température. On l'appelle capacité thermique C, aussi appelée capacité calorifique, le quotient entre la quantité de chaleur (Q) et la variation de température subie par le corps (Δt), voir :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
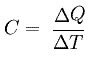
L'unité de capacité thermique est la calorie par degré Celsius (cal/°C).
Elle est définie comme la chaleur spécifique, également appelée capacité thermique, la valeur numérique de la quantité de chaleur qui provoque la variation d'un degré Celsius dans un gramme de la substance. Mathématiquement, nous le définissons comme le rapport entre la capacité calorifique et la masse du corps.

L'unité de chaleur spécifique est cal/g°C.
Équation fondamentale de la calorimétrie
En combinant les équations qui définissent la capacité thermique et la chaleur spécifique, nous pouvons arriver à l'équation qui fournit la quantité de chaleur sensible échangée par le corps de masse m lorsque sa température change.
Q = m.c.ΔT
Où c est la chaleur spécifique de la substance et ΔT est la variation de température de la substance.
Par Marco Aurélio da Silva
Équipe scolaire du Brésil
Voir plus !!
Calorimètre et échanges thermiques
Sachez à quoi sert un calorimètre.
Thermologie - La physique - École du Brésil
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
SANTOS, Marco Aurélio da Silva. « Échange de chaleur et propagation »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/fisica/propagacao-calor.htm. Consulté le 27 juin 2021.