Le texte Titrage a montré comment est réalisée cette technique d'analyse volumétrique, dont l'objectif principal est identifier la concentration d'une solution par sa réaction avec une autre solution de concentration connue.
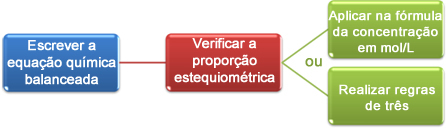
Maintenant, nous allons voir comment utiliser les données obtenues lors du titrage pour arriver à la concentration souhaitée, qui peut être un acide ou une base en solution. Pour ce faire, il y a essentiellement trois étapes :
Regardons un exemple :
Disons qu'un chimiste avait une solution d'acide acétique (vinaigre (CH3COOH(ici))) et voulait connaître sa concentration en mol/L. Ensuite, il a placé 20,0 mL de vinaigre (titré) dans un erlenmeyer et a ajouté l'indicateur de phénolphtaléine. Puis il a rempli une burette de 100 ml avec de l'hydroxyde de sodium (NaOH) de concentration connue (titrant) égale à 1,0 mol/L. Enfin, le chimiste a effectué le titrage et a remarqué que le changement de couleur (point de retournement - lorsqu'il a arrêté le titrage) s'est produit lorsque 24 ml de NaOH ont été consommés.

Sur la base de cette expérience, il a obtenu les données suivantes :
MCH3COOH= ?
VCH3COOH = 20 ml = 0,02 L
MNaOH = 24 ml = 0,024 L
VNaOH = 1,0 mol/L
Où M = concentration en mol/L et V = volume en L.
Pour connaître la concentration en acide acétique, il faut d'abord savoir écrire l'équation chimique qui représente la réaction de neutralisation correctement équilibrée qui s'est produite. Dans ce cas, la réaction est la suivante :
1 canal3COOH(ici) + 1 NaOH(ici) → 1 NaC2H3O2(aq) + 1 heure2O(ℓ)
Cette partie est importante pour voir le rapport stoechiométrique auquel les réactifs réagissent. Notez que le rapport est de 1:1, c'est-à-dire que pour chaque mole d'acide acétique, 1 mole d'hydroxyde de sodium est nécessaire.
Nous pouvons maintenant procéder aux calculs de deux manières :
(1er) Par la formule: M1. V1 = M2. V2
Puisque le rapport stoechiométrique est de 1:1, nous devons: nonCH3COOH = nNaOH .
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Étant M = n/V → n = M. V. Ainsi, on arrive à la liste ci-dessus, qui peut, dans ce cas, s'écrire ainsi: MCH3COOH. CH3COOH = MNaOH. VNaOH
Alors, remplacez simplement les valeurs de cette formule :
MCH3COOH. V CH3COOH = MNaOH. VNaOH
MCH3COOH. 0,02 L = 1,0 mol/L. 0,024 L
MCH3COOH = 0,024 mole
0,02 L
MCH3COOH = 1,2 mol/L
Par conséquent, la concentration initiale de la solution d'acide acétique, notre titre, était 1,2 mol/L.
Note importante: Si le rapport stoechiométrique n'était pas de 1:1, il suffirait de multiplier la concentration en mol/L (M) des substances par leurs coefficients respectifs. Par exemple, si le rapport était de 1:2, nous aurions ce qui suit :
M1. V1 = 2. M2. V2
Mais voici une autre façon d'effectuer ces calculs :
(2e) Par des règles de trois :
1 canal3COOH(ici) + 1 NaOH(ici) → 1 canal3COONa(ici) + 1 heure2O(ℓ)
1 mol 1 mol 1 mol 1 mol
1. 60g 1. 40 grammes 1. 82 grammes 1. 18 grammes
Ces masses sont les masses moléculaires calculées pour chaque substance.
* Sachant que le volume utilisé de la solution de 1,0 mol/L de NaOH(ici) était de 24 mL, on peut d'abord connaître la quantité de matière (mol) de NaOH qui a réagi :
1 mol de NaOH → 1,0 L
1 mole de NaOH 1000 ml
x 24 ml
x = 0,024 mol de NaOH
* Étant donné que le rapport est de 1:1, la quantité de matière (mol) d'acide acétique doit être la même que NaOH: 0,024 mol.
Observation: Si le rapport stoechiométrique était différent, nous le prendrions en compte dans cette partie. Par exemple, si elle était de 1:3 et que la quantité de matière d'une espèce chimique réactive était égale à 0,024 mol, alors celle de l'autre substance serait triple: 0,072.
* Maintenant on calcule :
20 ml de vinaigre 0,024 mol d'acide acétique
1000 ml de vinaigre et
y = 1,2 mol
C'est-à-dire qu'il y a 1,2 mol/L, ce qui est la même valeur que nous avons obtenue dans la méthode précédente.
Par Jennifer Fogaça
Diplômé en Chimie