Équilibrethermique est la condition dans laquelle un corps se trouve dans le mêmeTempérature que leur environnement. On observe que tous les corps qui sont à des températures plus élevées que leurs voisins ont tendance à leur donner de la chaleur spontanément jusqu'à ce que les deux commencent à présenter la même température.
Voirégalement:Fondamentaux de la thermologie
L'équilibre thermique et la loi zéro de la thermodynamique
L'équilibre thermique est le concept central derrière la loi zéro de la thermodynamique. Cette loi établit que, dans le cas où deux systèmes thermodynamiques, LES et B, sont en équilibre thermique avec un troisième système thermodynamique, Ç, ensuite, LES et B ils seront également en équilibre thermique.
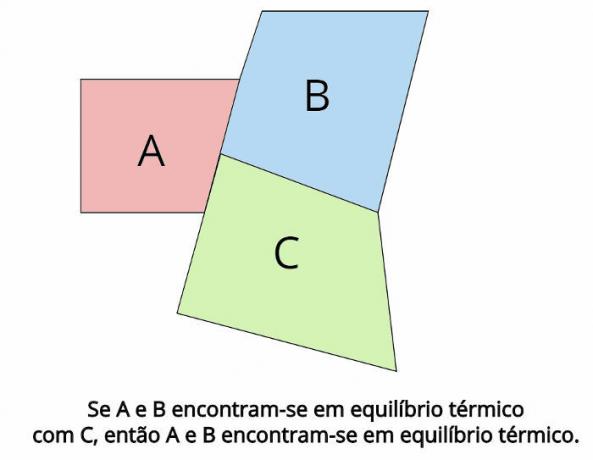
En équilibre thermique, les températures finales de chaque corps doivent être égales: TLES = TB = TÇ
Découvrez ce que l'énoncé de la loi zéro de la thermodynamique établit :
“Si deux corps sont en équilibre thermique avec un troisième corps, alors ces corps seront en équilibre thermique l'un avec l'autre.
Une autre façon de comprendre l'équilibre thermique est basée sur l'énergie interne des corps. L'énergie interne, ou simplement l'énergie thermique, est une grandeur physique directementproportionnel à Température du corps. Par conséquent, s'il existe des corps avec des températures différentes dans le même système thermodynamique, ils auront différents modules de énergie interne et donc transférera une partie de cette énergie entre eux jusqu'à ce qu'il n'y ait plus de différence entre leurs énergies. interne. Vous voulez en savoir plus sur ce qu'est l'énergie interne et quelles sont ses propriétés? Accéder à l'article: Énergie interne.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
chaleur et bilan thermique
Le transfert de chaleur se produit toujours spontanément, du corps avec la température la plus élevée vers le corps avec la température la plus basse. Ce transfert d'énergie sous forme de chaleur peut se produire par le biais de processus tels que conduite, convection et radiation.
Conduite: C'est le transfert de chaleur entre les corps qui se produit surtout dans les solides. Dans ce type de conduction, aucun transfert de masse ne se produit. Ce type de transfert de chaleur explique comment l'équilibre thermique se produit dans les métaux, par exemple.
Convection: C'est un transfert de chaleur qui a lieu dans les fluides. Dans ce mode de transfert de chaleur, il y a transfert de masse, lorsque le fluide chauffé se déplace, formant des courants de convection jusqu'à ce que tout le fluide atteigne l'équilibre thermique.
Radiation: C'est la transmission de chaleur par les ondes électromagnétiques, donc ce processus se produit même s'il n'y a pas de milieu physique entre le corps et un autre corps à des températures différentes. La chaleur qui est transférée, dans ce cas, est l'équivalent d'ondes électromagnétiques avec moins d'énergie que la lumière visible, étant ainsi un rayonnement thermique, situé dans la région de la infrarouge.
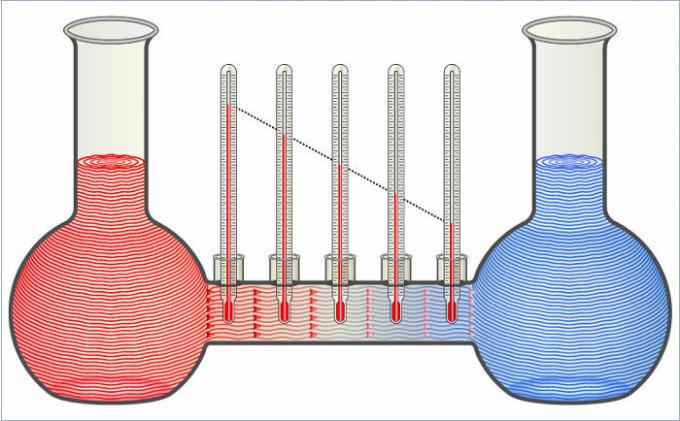
Les deux liquides de la figure se transfèrent de la chaleur jusqu'à ce que leurs températures soient égales.
Vous souhaitez en savoir plus sur le déroulement de chacun des processus de transfert de chaleur? Accéder à l'article: Processus de propagation de la chaleur.
chaleur sensible
quand il y a différencedansTempérature entre deux corps, ou entre un corps et son environnement, il y aura un échange de chaleur entre eux spontanément, de sorte que le le corps à haute température se refroidit et les corps à basse température se réchauffent jusqu'à ce qu'ils atteignent tous la température dans équilibrethermique.
La quantité de chaleur échangée entre les corps à différentes températures est appelée chaleur sensible et ce montant peut être calculé à partir de la formule indiquée dans la figure ci-dessous :
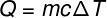
Q – chaleur (chaux ou J)
m – masse (g ou kg)
ç - chaleur spécifique (cal/gºC ou J/kg. K)
T – variation de température (°C ou K)
Dans la formule ci-dessus, il est important de souligner la grandeur du nom chaleur spécifique. une telle grandeur mesure la quantité d'énergie par masse qu'une substance doit céder ou absorber pour que sa température varie de 1°C. Dans le cas de l'eau pure, par exemple, et dans des conditions de pression normales, pour faire varier sa température de 1 °C, il faut 1,0 calorie pour chaque gramme d'eau.
Ainsi, toutes les substances qui ont établi un contact thermique les unes avec les autres tendent à atteindre l'état de équilibrethermique au fil du temps spontanément, cependant, certains nécessitent une plus grande quantité d'énergie pour le faire et cela affecte directement la température pour atteindre l'équilibre thermique.
liségalement:Qu'est-ce que la température ?
chaleur latente
Il est possible que lors d'échanges thermiques avec son environnement, un corps présente une pression, une température et un volume qui lui font subir un changement d'état physique. Ces changements se produisent dans Températureconstant (pour les corps composés d'une seule substance, sans impuretés), c'est-à-dire qu'en recevant ou en donnant de la chaleur au milieu extérieur, la température de ces corps ne change pas.
Ceci n'est possible que parce que toute l'énergie échangée, dans ce cas, est utilisée pour changer la conformation de vos molécules. A partir du moment où la barrière énergétique est « surmontée » et que tout le contenu du corps est dans un autre état physique, le Le corps continue à échanger de la chaleur avec son environnement, à moins, bien sûr, que sa température soit égale à la température extérieure.
O chaleur latente peut être calculé à partir de la formule illustrée dans la figure ci-dessous, vérifiez-la :
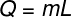
Q – chaleur latente (chaux ou J)
m – masse (g ou kg)
L – chaleur latente spécifique (cal/g ou J/kg)
Formule d'équilibre thermique
Au cas où nous voudrions savoir quel est le Températuredanséquilibre d'un système thermodynamique, il faut que nous considérions le système en question comme un systèmeisolé, c'est-à-dire que nous devons supposer qu'aucune quantité de chaleur n'est échangée avec les voisinages de ce système.
A partir de cette condition, on peut dire que toute la quantité de chaleur échangée n'est échangée qu'entre les corps qui composent ce système, sans tenir compte des pertes de chaleur pour les parois du conteneur, par exemple. Dans ce cas, on dit que le conteneur a capacité thermique négligeable, c'est-à-dire qu'il n'absorbe aucune chaleur.
Imaginez la situation suivante: dans une tasse de thé chaud, avec une capacité calorifique négligeable, versez des glaçons. Afin de déterminer la température d'équilibre thermique, en plus de connaître les conditions initiales du système, nous devons faire quelques considérations :
Toute la quantité de chaleur que le thé chaud donne à la glace sera entièrement absorbée par celle-ci, car la tasse a une capacité calorifique négligeable.
Nous devons faire abstraction des pertes de chaleur dans l'air et dans tout autre environnement, de sorte que cette tasse de thé puisse être comprise comme un système thermodynamique fermé.
De cette façon, nous pouvons établir que toute la quantité de chaleur reçue par la glace a été abandonnée par le thé chaud, avec cela, nous avons écrit notre formule pour calculer le bilan thermique :
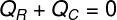
QR – Chaleur reçue
QÇ – chaleur donnée en
La chaleur donnée dans (QÇ), fait référence à la quantité de chaleur que le thé chaud a transférée aux glaçons qui y sont insérés. Déjà la chaleur reçue (QR) est la quantité de chaleur reçue par ces glaçons. Cette quantité de chaleur aura deux natures: la chaleur sensible et chaud latent, puisque, pour entrer en équilibre thermique, les glaçons vont probablement fondre.
Détermination de la température d'équilibre thermique
Déterminons la température d'équilibre thermique à partir de la situation suivante :
Une tasse, de capacité thermique négligeable, qui contient 200 ml (200g) de thé à une température initiale de 70°C, reçoit 10g de glace à une température de -10°C. Déterminez la température d'équilibre thermique du système (supposez que la chaleur spécifique du thé est égale à la chaleur spécifique de l'eau) :
Données:
çL'EAU = 1,0 cal/g°C
çGLACE = 0,5 cal/g°C
LGLACE = 80 cal/g
Premièrement, nous considérons que toute la chaleur reçue par la glace a été donnée par le thé :

Ensuite, il est nécessaire de détailler quelles formes de chaleur ont été données et reçues :
Thé: Le thé ne donnait qu'une chaleur sensible (Qs), puisque sa condition physique n'a pas changé.
Glace: La glace était initialement à -10°C, elle a donc reçu de la chaleur sensible (Qs) jusqu'à une température de 0 ºC, puis a reçu de la chaleur latente (QL) se liquéfier. Après être devenu liquide, il a reçu de la chaleur latente (Qs) jusqu'à ce qu'il entre en équilibre thermique (TF) avec du thé.
En traduisant ce qui a été analysé ci-dessus sous forme d'équation, nous aurons le calcul suivant à résoudre :
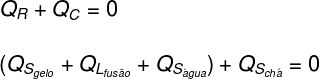
En remplaçant les données fournies par l'exercice dans l'équation trouvée ci-dessus, nous devrons résoudre le calcul suivant :
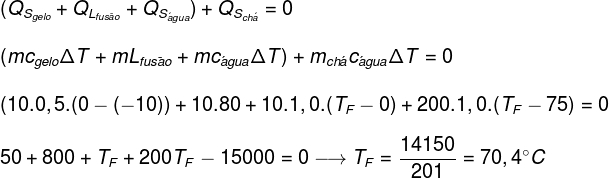
D'après le calcul effectué ci-dessus, la température d'équilibre du système thé+glace devrait être d'environ 70,4°C.
Expérience de bilan thermique
Pour tester l'équilibre thermique entre deux corps, on peut réaliser plusieurs expériences. Le plus simple d'entre eux, cependant, implique l'utilisation d'un calorimètre c'est un thermomètre. Le calorimètre est un récipient adiabatique (qui ne permet pas le passage de la chaleur), avec capacité thermique à propos denégligeable, comme un pot recouvert de polystyrène par exemple, qui est un bon isolant thermique.

Le calorimètre est utilisé pour mesurer la variation de température du système à l'intérieur.
Bilan thermique et vie sur Terre
O équilibrethermique il joue un rôle fondamental dans la vie terrestre. Sans la présence de gaz à effet de serre dans l'atmosphère terrestre, la plupart des Radiation thermique de la planète le quitterait, se propageant dans l'espace. Au fil du temps, cela provoquerait un refroidissement massif à travers la planète, provoquant le gel des océans au fil du temps.
De plus, les océans jouent un rôle clé dans équilibrethermique de la planète. En raison de sa grande Pâtes et Chaufferspécifique, les océans sont dotés d'un immense capacitéthermique, c'est-à-dire qu'ils ont besoin de recevoir d'énormes quantités de chaleur pour changer leur température. Pour cette raison, ils sont capables de réguler très efficacement la température de la planète. Les régions éloignées des océans et avec peu d'eau ont tendance à avoir de grandes plages thermiques, comme dans le cas des déserts, qui sont extrêmement chauds le jour et glacials la nuit.
Par conséquent, la équilibrethermique c'est un processus d'une importance fondamentale pour le maintien des processus physiques, chimiques et biologiques sur la planète et, par conséquent, essentiel pour l'existence de la vie sur Terre.
Par moi Rafael Helerbrock



