Le nom chimique de Vitamine C é Acide L-ascorbique, ou simplement Acide ascorbique. Ce nom traduit les rôles chimiques et biologiques de ce composé. L'aspect chimique est qu'il est acide, car il contient dans sa structure un groupe phénolique-hydroxy. Le groupe phénolique attaché au troisième carbone de la chaîne subit une ionisation en solution aqueuse, comme indiqué ci-dessous, libérant l'ion hydroxon (H3O+), qui est caractéristique du comportement acide :
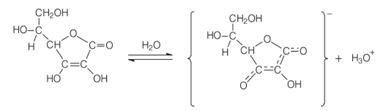
Le mot « ascorbique » vient de sa propriété biologique de lutter contre la maladie appelée scorbut. Et le « L » vient du fait que l'acide ascorbique a un centre asymétrique au carbone 5, ayant une activité optique. Cependant, son activité anti-scorbut dérive presque entièrement de l'isomère L (lévogyre), qui a une rotation spécifique dans l'eau de 24°.
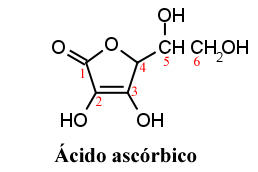
L'acide ascorbique a été isolé pour la première fois par le chercheur hongrois Szent-Györgi en 1922 sous forme de poudre cristalline blanche.
Les humains et autres animaux tels que les singes, certains oiseaux et certains poissons ne peuvent pas synthétiser la vitamine C. La carence de cette vitamine dans le corps entraîne une synthèse défectueuse du tissu collagène et la maladie susmentionnée, la
scorbut.Entre le principales sources de vitamine C, nous avons des fruits frais, comme la cerise, la noix de cajou, la goyave, le cassis, la mangue, l'orange, l'acérola, la tomate, entre autres. Les pommes de terre sont également une excellente source de vitamine C, tout comme les poivrons et les légumes à feuilles (bertalha, brocoli, chou frisé, navets, feuilles de manioc et ignames).

On dit "fruits Frais» car la vitamine C peut être partiellement ou totalement détruite lors de longues périodes de stockage. Par exemple, chaque mois stocké, la pomme de terre perd 15 % de sa vitamine C. De plus, la chaleur peut également le détruire. Les aliments cuits longtemps et les aliments ayant subi une transformation industrielle contiennent peu de vitamine C. Dans le cas de la pomme de terre, si elle est cuite sans la peau, elle perdra immédiatement 30 à 50 % de sa propriété.
L'une des principales propriétés de l'acide ascorbique est sa capacité à agir comme agent réducteur. Puisqu'il a une facilité exceptionnelle d'être oxydé en solution aqueuse, c'est un agent puissant antioxydant, car il peut s'oxyder à la place d'autres composés.
Par exemple, dans la vie de tous les jours, lorsque nous coupons certains fruits, comme les poires, les bananes et les pommes, ils noircissent avec le temps. En effet, ces fruits contiennent l'enzyme polyphénol oxydase, qui provoque l'oxydation enzymatique des composés phénoliques naturels en présence d'oxygène moléculaire, formant des quinones. Ils polymérisent et génèrent des mélanines, qui sont exactement les pigments sombres et insolubles que nous voyons se former dans ces fruits.
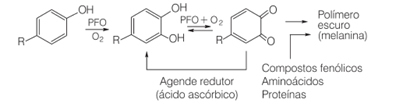
L'un des moyens d'inhiber l'action de l'enzyme polyphénol oxydase est l'ajout d'acide ascorbique. Cela se fait, par exemple, lorsque nous ajoutons du jus d'orange à une salade de fruits.
En présence d'oxygène et d'un catalyseur, l'acide ascorbique s'oxyde, devenant le acide déhydroascorbique. Cet acide a un pH inférieur à 4 et une baisse du pH des tissus du fruit ralentit la réaction de brunissement. A pH inférieur à 3, il n'y a pas d'activité enzymatique.
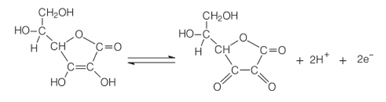
Cette propriété de la vitamine C est largement utilisée dans industrie alimentaire pour éviter l'apparition de goût désagréable, de toxicité et pour des raisons économiques, puisque estime qu'environ 50% de la perte de fruits tropicaux dans le monde est due à l'enzyme polyphénol oxydase.
En raison de son rôle antioxydant, la vitamine C est également utilisée dans produits de beauté. Son application topique à travers ces cosmétiques permet d'atteindre des niveaux qui ne sont pas possibles avec l'apport oral de vitamine C seule. Il protège la peau contre les rayons UV et les radicaux libres qui entraînent un vieillissement prématuré.

Par Jennifer Fogaça
Diplômé en Chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/composicao-aplicacoes-vitamina-c.htm
