À unités de mesure ce sont des représentations de grandeurs physiques utilisées dans différents domaines de la connaissance afin de quantifier une matière, une sensation, le temps ou la taille de quelque chose, par exemple.
Partout dans le monde, les unités de mesure suivent un modèle déterminé par le Système international d'unités (SI). A partir de l'unité standard établie par le Système international, on peut encore utiliser d'autres unités qui en dérivent, ce qui permet de comparer et d'élargir la notion quantitative de quantité.
Le système international adopte l'unité kelvin, par exemple, comme norme pour la température de la quantité. Cette unité est largement utilisée dans les expériences de laboratoire, mais dans la vie de tous les jours, la plupart des pays utilisent l'unité degrés Celsius, dérivée de l'unité kelvin.
A lire aussi: Grandeurs vectorielles et scalaires
unités de masse
Les unités les plus utilisées pour travailler avec la masse d'une matière sont :
Tonne (t);
Kilogramme (kg) [unité de masse standard selon SI] ;
Gramme (g);
Milligramme (mg).
Pour convertir une unité en une autre, suivez simplement ces relations :
1 t = 1000 kg
1kg = 1000g
1 g = 1000 mg
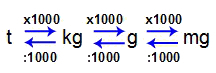
Relation entre les unités de masse
Comme on peut le voir, une unité de masse est toujours 1000 fois plus grande que l'autre. Voir quelques exemples :
→ Conversion des unités de masse
Exemple 1: Transformons 2,5 kg en grammes.
Puisque 1 kg est égal à 1000 grammes, nous pouvons établir la règle de trois suivante :
1kg 1000g
2,5 kg x
X. 1 = 2,5.1000
x = 2500g
Exemple 2: Transformons 4 mg en kg.
Comme 1 kg équivaut à 1000000 de mg (résultat de la multiplication de 1000 x 1000 de la différence entre l'unité kg et mg), on peut mettre en place la règle de trois suivante :
1 kg 1000000 mg
x 4 mg
1000000.x = 4.1
x = 4
10000000
x = 0,000004 kg
unités de volume
mètre cube (m3) [unité de volume standard selon SI] ;
Litre (L) ou décimètre cube (dm3);
Millilitre (mL) ou centimètre cube (cm3).
Pour convertir une unité en une autre, suivez simplement ces relations :
1 mètre3 = 1000L
1L = 1 dm3
1L = 1000mL
1dm3 = 1000cm3
1cm3 = 1 ml

Relation entre les unités de volume
Comme on peut le voir sur le schéma ci-dessus, une unité de volume est toujours 1000 fois plus grande que l'autre. Lorsque nous comparons la plus grande unité (m3) avec la plus petite unité (mL ou cm3), la différence est de 1 000 000 fois.
→ Conversion des unités de volume
Exemple 1: transformons 4,5 m3 en dm3.
comme 1 m3 équivaut à 1000 dm3, on peut établir la règle de trois suivante :
1m3 1000 dm3
4,5 mètres3 X
x.1 = 4.5.1000
x = 4500 dm3
Exemple 2: transformons 300cm3 dans L.
Comme 1 L équivaut à 1000 cm3, on peut établir la règle de trois suivante :
1L 1000cm3
x 300cm3
1000.x = 300,1
x = 300
1000
x = 0,3 dm3
unités de pression
Les unités les plus utilisées pour travailler avec le pression elles sont:
Atmosphère (atm);
Millimètre de mercure (mmHg);
Centimètre de mercure (cmHg);
Pascal (Pa) ou kilopascal (KPa = 1000 Pa) [unité de pression standard selon SI].
Pour convertir une unité en une autre, suivez simplement ces relations :
1 atm = 101,325 kPa
1 atm = 101325 Pa
1 atm = 760 mmHg
1 atm = 76 cmHg
REMARQUE: Des relations à partir de atm ont été utilisées car les valeurs utilisées sont numériquement plus simples à travailler et/ou à mémoriser (si nécessaire).
→ Conversion des unités de pression
Exemple 1: Transformons 2 atm en KPa.
Comme 1 atm équivaut à 101 325 KPa, il suffit de mettre en place la règle de trois suivante :
1atm 101 325 KPa
2 guichets automatiques
x.1 = 2 101 325
x = 202, 650 KPa
Exemple 2: Transformons 200 mmHg en cmHg.
En utilisant les relations données ci-dessus, nous devons d'abord convertir 200 mmHg en atmosphère en utilisant la règle de trois suivante :
1 atm 760 mmHg
x 200 mmHg
x.760 = 200,1
x = 200
760
x = 0,26 atm
Nous transformons ensuite le résultat en atm en cmHg selon la règle de trois suivante :
1 atm 76 cmHg
0,26 atm y
y.1 = 0,26.76
y = 19,76 cmHg
Exemple 3: Transformons 500 cmHg en KPa.
En utilisant les relations données ci-dessus, nous devons d'abord convertir 500 cmHg en atm en utilisant la règle de trois suivante :
1 atm 76 cmHg
x 500 cmHg
x.76 = 500,1
x = 500
76
x = 6,57 atm
Nous transformons ensuite le résultat en atm en cmHg selon la règle de trois suivante :
1 atmosphère 101 325 KPa
6,57 atm y
y.1 = 6,57 101,325
y = 665,70 KPa
Voir aussi :Qu'est-ce que la pression atmosphérique ?
unités de température
Les unités les plus utilisées pour travailler avec Température elles sont:
Degré Celsius (OÇ);
degrés Fahrenheit (OF);
Kelvin (K) [unité de température standard selon SI].
Pour convertir une unité de température en une autre, nous pouvons utiliser les formules suivantes :
De degrés Celsius à Kelvin: TK = TOC+273
De degrés Celsius à Fahrenheit: TOÇ = TOF-32
5 9
→ Conversion des unités de température
Exemple 1: transformons 45 OC pour OF.
Pour effectuer la transformation, il suffit de mettre les données dans la formule ci-dessous :
TOÇ = TOF-32
5 9
45 = TOF-32
5 9
5.(TOF-32) = 45,9
5TOF - 160 = 405
5TOF = 405 + 160
TOF = 565
5
TOF = 113 OF
Exemple 2: transformons 200K en OÇ.
Pour effectuer la transformation, il suffit de mettre les données dans la formule suivante :
TK = TOC+273
200 = TOC+273
TOC = 200 - 273
TOC = - 73 OÇ
Pour en savoir plus sur la conversion de valeurs entre échelles thermométriques, lisez le texte suivant: Conversion entre échelles thermométriques.
unités de longueur
Les unités les plus utilisées pour travailler avec longueur elles sont:
Kilomètre (km);
Métro (m) [unité standard de longueur selon SI] ;
Centimètre (cm);
Décimètre (dm);
Millimètre (mm).
Pour convertir une unité en une autre, suivez simplement ces relations :
1km = 1000m
1m = 100cm
1 dm = 10 cm
1cm = 10mm
→ Conversion des unités de longueur
Exemple 1: Transformons 5 km en dm.
En analysant le diagramme, la différence entre km et dm est de l'ordre de 100 000, il suffit donc d'établir la règle de trois suivante :
1 km 100000 dm
5 km x
x.1 = 5,1 millions
x = 500000 dm
Exemple 2: Transformons 500 mm en cm.
Comme 1 cm équivaut à 10 mm, il suffit d'utiliser la règle de trois suivante :
1cm 10mm
x 500 mm
x.10 = 500,1
x = 500
10
x = 50cm
Unités énergétiques sous forme de chaleur
Les unités les plus utilisées pour travailler avec l'énergie sous forme de Chauffer elles sont:
Joule (J) ou kilojoule (KJ = 1000 J) [le joule est l'unité standard établie par le SI] ;
Calories (citron vert) ou kilocalories (Kcal = 1000 cal).
Pour convertir une unité en une autre, suivez simplement cette liste :
1 cal = 4,18 J
1Kcal = 4.18KJ
Voir quelques exemples :
Exemple 1: Transformons 2600 Kcal en KJ.
Comme 1 Kcal équivaut à 4,18 KJ, utilisez simplement la règle de trois suivante :
1 Kcal 4,18 KJ
2600 Kcal x
x.1 = 2600.4.18
x = 10868 KJ
unités de temps
Temps (h) ;
Minutes (minutes) ;
Seconde(s) [unité]standard de temps établi par l'IS].
Pour convertir une unité en une autre, suivez simplement ces relations :
1h = 60 min
1 min = 60 s

Relation entre les unités de temps
→ Conversion des unités de temps
Exemple 1: Transformons 6 h en secondes.
Comme 1 heure équivaut à 3600 secondes (le résultat de la multiplication 60x60 de la différence entre les heures et les secondes), il suffit de mettre en place la règle de trois suivante :
1 h 3600 s
6h x
x.1 = 6 3600
x = 21600 s
Exemple 2: transformons 600 s en minutes.
Comme 1 minute équivaut à 60 s, il suffit d'utiliser la règle de trois suivante :
1 min 60 s
x 600 s
x.60 = 600
x = 600
x = 600
60
x = 10 minutes
Mol (quantité de matière)
C'est l'unité qui établit la quantité d'entités (atomes, ions, électrons, neutrons, molécules) qui forment une matière donnée. Deuxième Amédée Avogadro, 1 mole de toute matière contient 6.02.1023 entités.
Exemple: 1 mole de H2O.
Une mole de la substance aqueuse a :
6,02.1023 molécules d'eau;
3.6,02.1023 atomes (le 3 est le résultat de la somme de 1 oxygène et 2 hydrogènes) ;
2.6,02.1023 atomes d'hydrogène;
1.6,02.1023 atomes d'oxygène.
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/unidades-medida.htm
