LES Chimie organique est une partie de la chimie qui gagne chaque année en importance dans les examens d'entrée et dans Enem, en particulier le sujet réactions organiques. Dans cet esprit, ci-dessous, vous aurez accès à des conseils fondamentaux sur les réactions organiques pour faciliter vos études !
1er) Comment reconnaître un la combustion
La réaction de combustion est une réaction dans laquelle tout composé organique (tel que le méthane) réagit avec l'oxygène gazeux pour former de l'eau et un gaz carbonique (tel que le dioxyde de carbone).
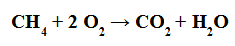
Équation représentant la combustion d'un composé organique
2e) Quels sont les produits issus d'une réaction de combustion ?
Les produits issus d'une réaction de combustion dépendent du type de combustion :
Combustion complète: est celui dans lequel on a la formation d'eau et de dioxyde de carbone (CO2) .
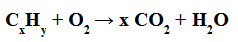
Exemple d'équation de combustion complète
Combustion incomplète: est celui dans lequel nous avons la formation d'eau et de monoxyde de carbone (CO).

Exemple d'équation de combustion incomplète
3e) Quelles sont les substances impliquées dans une réaction de photosynthèse?
La réaction de photosynthèse se produit lorsque les molécules de dioxyde de carbone réagissent avec les molécules d'eau, en présence de lumière et de chlorophylle, pour former des molécules de glucides (comme le glucose).
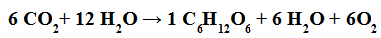
Équation chimique représentant la photosynthèse
Les réactions d'addition sont celles dans lesquelles les liaisons pi d'une chaîne sont rompues et chacun des carbones qui formaient ces liaisons reçoit de nouveaux atomes.
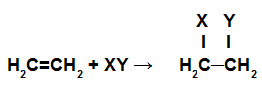
Représentation schématique d'une réaction d'addition
5e) Quels sont les réactifs possibles d'une réaction d'addition ?
Les substances organiques couramment utilisées dans une réaction d'addition sont :
alcène: Substance organique formée uniquement de carbones et d'hydrogènes, dans une chaîne ouverte avec une double liaison.
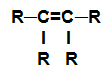
Formule développée d'un alcène
REMARQUE: Le groupe R peut être un radical ou un élément hydrogène.
alcyne: Substance organique formée uniquement de carbones et d'hydrogènes, dans une chaîne ouverte avec une triple liaison.
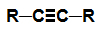
Formule développée d'un alcyne
alcadiène: Substance organique formée uniquement de carbones et d'hydrogènes, dans une chaîne ouverte avec deux doubles liaisons.
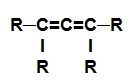
Formule développée d'un alcadiène
Cyclane:Substance organique formée uniquement de carbones et d'hydrogènes, en chaîne fermée et saturée.
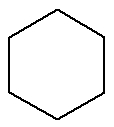
Formule développée d'un cyclane
Cycle: Substance organique formée uniquement de carbones et d'hydrogènes, en chaîne fermée et saturée.
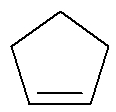
Formule développée d'un cyclène
Benzène
Substance organique formée par une chaîne fermée et composée de six carbones, trois doubles liaisons alternées et six atomes d'hydrogène.

Formule développée du benzène
6e) Quels sont les produits possibles d'une réaction d'addition ?
Les produits d'une réaction d'addition dépendent de la substance qui réagit avec les composés organiques (alcène, alcyne, alcadiène, etc.). Voir les principales réactions d'addition et leurs produits possibles :
Ce sont des réactions dans lesquelles, en plus de la substance organique, l'un des réactifs doit être de l'hydrogène gazeux (H2). Dans cette réaction, la liaison pi est rompue et chacun des carbones qui formaient la liaison reçoit un atome d'hydrogène. S'il y a plus d'un lien pi, le processus est répété. Il y a formation d'un hydrocarbure.
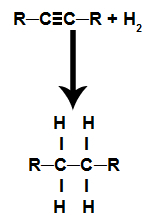
Équation représentant l'hydrogénation d'un alcyne
Ce sont des réactions dans lesquelles, en plus de la substance organique, l'un des réactifs doit être une substance simple formée par halogène. Dans cette réaction, la liaison pi est rompue et chacun des carbones qui formaient la liaison reçoit un atome d'halogène. S'il y a plus d'un pi, le processus est répété.
Nous aurons la formation de halogénures organiques vicinales (ceux dont deux carbones dans la chaîne sont voisins et contiennent un halogène).
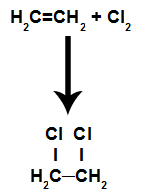
Équation représentant la chloration d'un alcène
c) Addition par halogénure d'acide
Ce sont des réactions dans lesquelles, en plus de la substance organique, l'un des réactifs doit être un halogénure d'acide (HCl, HBr, HI, HCl). Dans cette réaction, la liaison pi est rompue et l'hydrogène de l'acide passe à un carbone et l'halogène à un autre. S'il y a plus d'un pi, le processus est répété. Nous aurons la formation d'un hydrocarbure.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
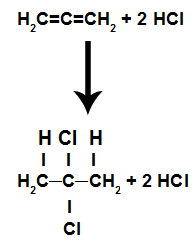
Équation représentant l'addition d'halogénure d'acide d'un alcadiène
d) Hydratation
Ce sont des réactions dans lesquelles, en plus de la substance organique, l'un des réactifs doit être l'eau (H2O). Dans cette réaction, la liaison pi est rompue et l'hydrogène dans l'eau va à un carbone et le groupe OH dans l'eau va à un autre carbone. S'il y a plus d'un pi, le processus est répété. Nous aurons la formation d'un hydrocarbure.
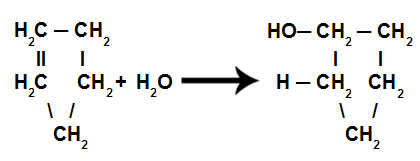
Équation représentant l'hydratation du cyclène
7e) Comment reconnaître une réaction de substitution
Une réaction de substitution est une réaction dans laquelle un composé organique échange un ou plusieurs atomes d'hydrogène avec un atome ou un groupe de la substance qui réagit avec lui.

Représentation schématique d'une réaction de substitution
8e) Quels sont les réactifs possibles d'une réaction de substitution ?
Les substances organiques couramment utilisées dans une réaction de substitution sont :
hydrocarbure: Substance organique formée uniquement de carbones et d'hydrogènes, en chaîne ouverte et saturée.
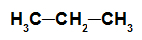
Formule développée d'un alcane
Benzène
Déjà démontré dans le 5ème conseil.
→ Dérivés du benzène: substances organiques dans lesquelles un ou plusieurs hydrogènes sont échangés contre d'autres atomes ou des groupes différents.
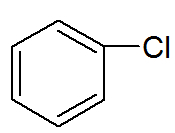
Formule développée d'un dérivé du benzène
halogénure organique
Substance organique formée d'atomes de carbone, d'hydrogène et d'un ou plusieurs halogènes (chlore, brome, iode et fluor), en chaîne ouverte ou fermée, saturée ou insaturée.

Formule développée d'un halogénure organique
9e) Quels sont les produits possibles d'une réaction de substitution
Les produits d'une réaction de substitution dépendent de la substance qui réagit avec les composés organiques. Voir les principales réactions de remplacement et leurs produits possibles :
a) Halogénation
Ce sont des réactions dans lesquelles, en plus de la substance organique, l'un des réactifs doit être une substance simple formée d'halogène.
Dans cette réaction, un hydrogène dans le composé organique est remplacé par un atome d'halogène, formant un halogénure d'acide et un acide inorganique.

Équation représentant la chloration d'un alcane
Réaction dans laquelle le composé organique réagit avec l'acide nitrique (HNO3). Dans cette réaction, le composé perd un hydrogène et reçoit le groupe nitro (NO2), résultant en une composé nitro et de l'eau, quel que soit le composé organique qui a réagi avec l'acide.
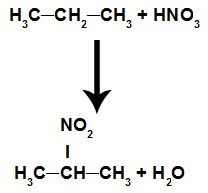
Équation représentant la nitration des alcanes
Réaction dans laquelle le composé organique réagit avec l'acide sulfurique (H2SEUL4). Dans cette réaction, le composé perd un hydrogène et reçoit le groupe sulfonique (SO3H), résultant en une acide sulfonique et de l'eau, quel que soit le composé organique qui a réagi avec l'acide.

Équation représentant la sulfonation du benzène
Réaction dans laquelle le composé organique réagit avec un halogénure organique. Dans cette réaction, le composé organique perd un hydrogène et reçoit le radical qui était attaché à l'halogène dans l'halogénure organique. La réaction se traduit par hydrocarbure et un acide inorganique, quel que soit le composé organique qui a réagi avec l'acide.

Équation représentant l'alkylation du benzène
Réaction dans laquelle le composé organique réagit avec un halogénure d'acide.
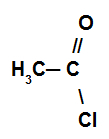
Exemple d'halogénure d'acide
Dans cette réaction, le composé organique perd un hydrogène et reçoit le groupe acyle de l'halogénure d'acide.
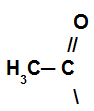
Représentation du groupe acyle de l'halogénure d'acide
La réaction se traduit par un cétone et un acide inorganique, quel que soit le composé organique qui a réagi avec l'acide.
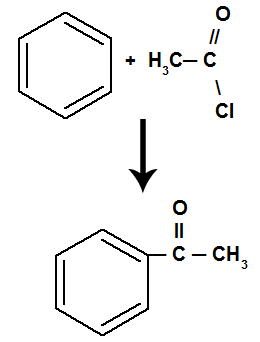
Équation représentant l'acylation du benzène
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. "Conseils fondamentaux sur les réactions organiques"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/dicas-fundamentais-sobre-reacoes-organicas.htm. Consulté le 28 juin 2021.



