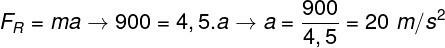À la fin du XVIIIe et au début du XIXe siècle, Lavosier, Proust, Dalton et d'autres scientifiques ont mené des études avec le but de déterminer la nature fondamentale de la matière, c'est-à-dire de découvrir comment et à partir de quoi la matière s'est formée. Ils expliquaient la matière comme étant constituée de particules indivisibles et conservées en quantité et en masse. Leurs théories étaient basées sur les résultats obtenus par des expériences menées par la combinaison de gaz, cependant, il y avait une difficulté à distinguer entre les atomes et les molécules en observant que les volumes de certains des gaz dans ces réactions n'étaient pas conformes à ce qui était déjà prédit dans les transformations de gaz connu.
La difficulté a été surmontée par un physicien italien nommé Amedeo Avogadro. Avogadro a affirmé que, dans les mêmes conditions physiques, des volumes égaux de gaz différents ont le même nombre de particules. Cependant, dire qu'un gaz a le même nombre de particules qu'un autre n'implique pas que les deux aient le même nombre d'atomes.
L'hypothèse d'Avogadro selon laquelle des volumes égaux de gaz différents, dans les mêmes conditions de pression et de température, contiennent le même nombre de particules et les idées sur les masses atomiques et moléculaires d'un autre scientifique nommé Canizarro ont conduit à la détermination de la constante d'Avogadro.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
La constante établie par Avogadro et vérifiée plus tard expérimentalement par plusieurs scientifiques est actuellement connue sous le nom de Numéro d'Avogadro.
Numéro d'Avogadro () représente le nombre de particules ou de molécules contenues dans une mole.
Na=6.023×1023 particules
La mole représente la grandeur de la quantité de matière et la masse contenue dans 1 mole est appelée la masse molaire (M). Pour calculer le nombre de moles contenues dans une masse donnée m d'un gaz, la relation est utilisée :

L'équation 1 est obtenue par une simple règle de trois, où: 1 mol a une masse M et non les moles ont une masse m.
Par Nathan Augusto
Diplômé en Physique
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FERREIRA, Nathan Augusto. "Numéro d'Avogadro"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/fisica/a-lei-avogadro.htm. Consulté le 27 juin 2021.