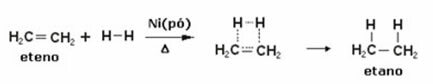
À formules chimiques sont des représentations utilisées pour indiquer quels éléments chimiques font partie de la composition de la substance et aussi pour représenter le type d'interaction entre les atomes participants.
Grâce à l'analyse de la formule d'une substance chimique, on peut déterminer la nature des liaisons chimiques (ionique, covalent ou métallique) qui l'ont formé, ainsi que son comportement physico-chimique. Certaines des propriétés qui sont liées au comportement physico-chimique d'une substance sont :
Solubilité
Point de fusion
Point d'ébullition
Réactivité
Connaissez maintenant les types de composés qui composent les produits chimiques ainsi que les formules qui les représentent.
Types de composés
Le) composés ioniques
Les composés ioniques sont toutes des substances chimiques formées par liaison ionique entre des atomes, c'est-à-dire que dans ces composés, il y a des atomes qui perdent et des atomes qui gagnent des électrons. La combinaison d'éléments chimiques qui forment ce type de composé peut être :
Métal avec un métal
Métal avec hydrogène
b) Composés covalents
Les composés covalents sont toutes les substances chimiques formées par liaison covalente entre des atomes, c'est-à-dire que dans ces composés, il y a des atomes qui partagent des électrons entre eux. La combinaison d'éléments chimiques qui forment ce type de composé peut être :
amétal à amétal
Un métal avec de l'hydrogène
hydrogène avec hydrogène
c) Composés métalliques
Les composés métalliques sont toutes les substances chimiques formées par les atomes d'un seul élément métallique. Dans ces composés, les atomes ne partagent que des électrons entre eux.
Formules pour les composés ioniques
Le) formule ionique
La formule ion indique le nombre d'atomes qui forment l'unité ionique du composé, comme dans le cas du chlorure de sodium, dont l'ion de formule est NaCl. Dans la formule, on identifie la présence d'un atome de sodium et d'un atome de chlore.
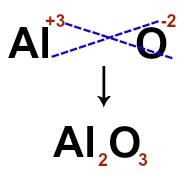
Pour construire la formule ionique, il suffit de croiser les charges de chacun des ions qui composent le composé ionique. Pour le cation Al+3 et l'anion O-2, par exemple, lorsque nous croisons les charges et négligeons les signaux, nous avons la formule ion suivante :
b) Formule électronique
La formule électronique est utilisée pour représenter la perte et le gain d'électrons des atomes impliqués dans la formation du composé. Autour de l'abréviation de chaque élément, on a chacun des électrons du couches de valence.
Dans le cas du chlorure de sodium (NaCl), dans Na nous avons un seul électron de valence (car il est de la famille IA) et, dans Cl, nous avons sept électrons de valence (car il est de la famille VIIA) représentés.
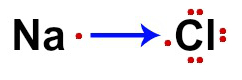
Formule électronique NaCl
Le gain d'un électron par Cl (non métallique) et la perte d'un électron par Na (non métallique) sont représentés par une flèche. Selon le théorie de l'octet, Na perd un électron pour n'en avoir qu'un, et Cl en gagne un pour compléter huit électrons de valence.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Pour les composés covalents
a) Formule moléculaire
La formule moléculaire est utilisée pour représenter, sous une forme simplifiée, une substance covalente. La formule moléculaire de l'eau, qui est H2O, par exemple, a deux atomes d'hydrogène et un atome d'oxygène.
Contrairement à la formule ionique des composés ioniques, la formule moléculaire d'un composé covalent n'est pas construite avec autant simplicité, car différentes quantités d'atomes des mêmes éléments forment différentes substances, telles que l'eau (H2O) et le peroxyde d'hydrogène (H2O2).
Il est très courant, dans les exercices, la formule moléculaire :
Être fourni par l'exercice lui-même;
Être déterminé par un calcul;
Être déterminé en comptant chaque élément de la formule structurelle ;
Être déterminé à partir du nom de la substance.
b) Formule développée
La formule structurelle d'une substance covalente est utilisée pour représenter le nombre de liaisons que chacun des atomes fait dans la molécule. Les liens qui sont utilisés dans la formule structurelle sont :
Lien unique: représenté par un tiret (─), indique un lien unique ;
Double liaison: représentée par deux tirets (=), indique deux liaisons ;
Triple liaison: représentée par trois tirets (≡), indique trois liaisons ;
lien datif: représenté par une flèche (→), indique une seule connexion.
La formule structurale des composés covalents doit être représentée, autant que possible, en fonction de la géométrie moléculaire de la molécule en question. Voir la représentation de la formule développée de l'ammoniac, qui a une géométrie pyramidale :
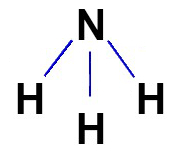
c) Formule électronique
La formule électronique d'un composé covalent démontre le partage d'électrons entre les atomes qui composent la molécule. Au lieu des tirets utilisés dans la formule structurelle, nous avons l'utilisation de sphères pour représenter les électrons partagés entre les atomes. Voir:
Liaison simple: partage de deux électrons (un de chacun des atomes impliqués) ;
Double liaison: partage de quatre électrons (deux de chacun des atomes impliqués) ;
Triple liaison: partage de six électrons (trois de chacun des atomes impliqués) ;
Lien datif: partage de deux électrons (tous deux issus d'un même atome entre ceux impliqués),
Ainsi, pour l'ammoniac, dont la formule développée a été représentée ci-dessus, sa formule électronique est :
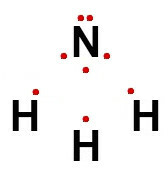
Pour les composés métalliques
Les composés métalliques, car formés exclusivement par des atomes d'un même métal, ont pour formule chimique l'abréviation de l'élément chimique :
Substance de cuivre: Cu
Substance aurifère: Au
Substance ferreuse: Fe
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. "Formules de substances chimiques"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/formulas-substancias-quimicas.htm. Consulté le 27 juin 2021.