O principe du Chatelier nous dit que lorsqu'une perturbation est causée à un système en équilibre, elle se déplacera dans la direction qui minimise les forces créées par cette perturbation et rétablit un nouvel équilibre chimique.
L'une de ces perturbations est la variation de température. Cette variation est importante car, en plus de provoquer le changement d'équilibre, elle modifiera également la valeur de la constante d'équilibre, Kç.
Pour mieux comprendre comment cela se produit, regardons un exemple :
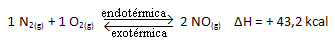
Kç = _[ AU]2___
[N2]. [O2]
La réaction ci-dessus se produit dans le sens direct avec absorption d'énergie, elle est endothermique. Le processus inverse, d'autre part, se produit avec la libération d'énergie, étant une réaction exothermique.
Ainsi, si nous augmentons la température du système, l'équilibre chimique se déplacera vers la réaction endothermique, qui dans cette réaction est à droite. C'est ainsi que la chaleur est absorbée et que l'équilibre est retrouvé.
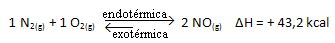
L'inverse est également vrai; si nous abaissons la température de ce système, la réaction se déplacera dans le sens où elle dégagera de la chaleur, car l'énergie totale de la réaction diminuera. Cela signifie que l'équilibre va se déplacer vers la réaction exothermique, qui dans ce cas est à gauche :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
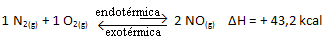
En bref:

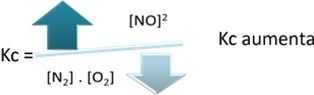
Par rapport à la constante d'équilibre (Kç), lorsque la température augmente, cela favorise la réaction endothermique et plus de NO(g) se forme, augmentant sa concentration et diminuant la concentration des réactifs. Notez dans la formule ci-dessous que la concentration de NO(g) est directement proportionnel à la constante Kç, par conséquent, il augmente également :
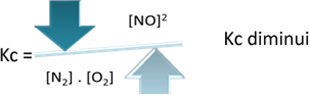
Mais si nous diminuons la température, déplaçant la réaction vers la réaction exothermique, la concentration du produit NO diminuera et les concentrations des réactifs augmenteront. Puisque les concentrations de réactifs sont inversement proportionnelles à la constante Kc, alors elle diminuera :
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « Variation de température et changement d'équilibre chimique »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/variacao-temperatura-deslocamento-equilibrio-quimico.htm. Consulté le 28 juin 2021.
Chimie

Testez vos connaissances et apprenez-en plus avec cette liste d'exercices résolus sur les équilibres chimiques. Grâce à ce matériel, vous pourrez mieux comprendre comment travailler les constantes d'équilibre (Kp, Kc et Ki), le décalage d'équilibre, le pH et le pOH, ainsi que l'équilibre dans les solutions dites tampons.