O Modèle atomique de Thomson a été proposé en 1898 par le physicien anglais Joseph John Thomson ou, simplement, J.J. Thomson. Après avoir eu plusieurs preuve expérimentale de l'existence de l'électron, il renversa la théorie de l'indivisibilité de l'atome proposée par John Dalton.
Thomson, sur la base de son modèle, a confirmé et prouvé l'existence de électrons (particules avec une charge électrique négative) dans l'atome, c'est-à-dire que l'atome a des particules subatomiques.
Carte mentale: modèle atomique de Thomson
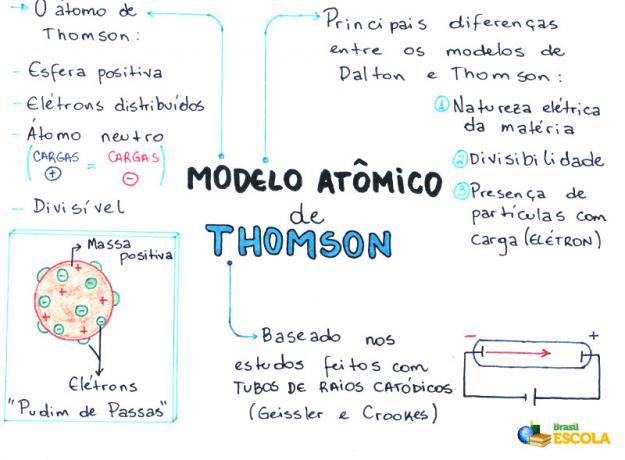
* Pour télécharger la carte mentale en PDF, Cliquez ici!
Thomson a proposé son modèle atomique sur la base de découvertes liées à la radioactivité et d'expériences réalisées avec le tube cathodique construit par les scientifiques Geissler et Crookes. Voir une représentation de ce tube :
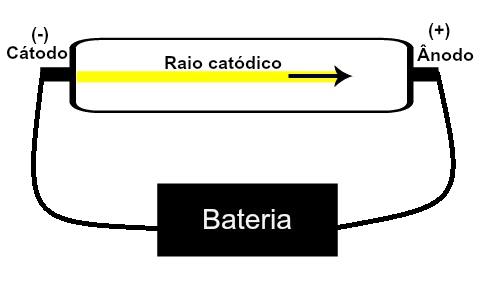
Lorsqu'un gaz raréfié à basse pression est soumis à une haute tension électrique (par exemple 15000 V), il produit une faisceau lumineux (composé de charges électriques) de la cathode (pôle négatif) vers l'anode (pôle positif).
Avec cette expérience, Thomson est arrivé à la conclusion que lorsque les atomes de la matière gazeuse à l'intérieur du tube ont été soumis à une haute tension, leurs électrons ont été arrachés et dirigés vers la plaque positif.
Considérations proposées par le modèle atomique de Thomson
Avec les expériences menées avec le tube cathodique, Thomson a proposé son interprétation de ce que seraient l'atome et sa constitution. Alors, selon lui :
- L'atome est une sphère, mais pas massive comme le propose le Modèle atomique de John Dalton;
- L'atome est neutre, puisque toute matière est neutre ;
- Comme l'atome a des électrons, qui ont des charges négatives, il doit donc avoir des particules positives pour que la charge finale soit nulle ;
- Les électrons ne sont pas fixés ou piégés dans l'atome, ils peuvent être transférés à un autre atome sous certaines conditions ;
- L'atome peut être considéré comme un fluide continu avec des charges positives où se répartiraient les électrons, qui ont une charge négative ;
- associé votre modèle à un pudding aux raisins (qui représentent les électrons) ;
- Comme les électrons qui sont diffusés ont la même charge, il y a une répulsion mutuelle entre eux, ce qui les rend uniformément répartis dans la sphère.
Nouveautés proposées à l'atome par le modèle de Thomson
Le modèle atomique de Thomson était le deuxième proposé pour l'atome. Le premier modèle a été formulé par John Dalton.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Le modèle de Thomson traitait de nouvelles connaissances sur l'atome qui jusqu'alors n'avaient pas été proposées faute de base scientifique, telles que :
- Nature électrique de la matière ;
- Séparabilité de l'atome ;
- Présence de petites particules chargées dans l'atome.
Problèmes signalés à l'atome de Thomson
Plusieurs physiciens au moment de la proposition du Modèle atomique de Thomson, basé sur les théories de la physique classique, a souligné certaines incohérences présentes dans ce modèle :
- Thomson a proposé que l'atome ait une stabilité par rapport à la distribution uniforme des électrons, qui pourrait être modifiée par l'influence de l'énergie. Cependant, la physique classique, basée sur électromagnétisme, ne permet pas l'existence d'un système stable basé uniquement sur la répulsion entre particules de même charge ;
- Pour Thomson, les électrons sont répartis uniformément dans l'atome, mais ils ont la capacité de se déplacer de manière accélérée et, par conséquent, doit émettre un rayonnement électromagnétique à certaines fréquences spécifique. Cependant, cela n'a pas été observé.
- Le modèle de Thomson était souvent inefficace pour expliquer les propriétés atomiques telles que leur composition et leur organisation.
* Carte mentale de Victor Ricardo Ferreira
Professeur de chimie
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. "Le modèle atomique de Thomson"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/o-atomo-thomson.htm. Consulté le 27 juin 2021.
Chimie

Niels Bohr, atome de Bohr, physique atomique, atome stable, modèle atomique, système planétaire, couches de l'électrosphère, niveaux d'énergie, couches d'électrons, énergie des électrons, modèle atomique de Rutherford, atome à l'état excité.
Chimie

Les atomes et la construction de l'Univers, théorie atomique, que tout est fait, la matière est composée d'atomes, Théorie des quatre éléments, anciens alchimistes, théorie atomique, particule fondamentale.



